
Solved NCERT Questions For Class 12 Chemistry Chapter 7 In Hindi - Free PDF
Through NCERT Solutions Class 12 Chemistry Chapter 7 In Hindi, explore all the important concepts about the p-Block Elements in an easy way. This chapter helps you understand tricky topics like electronic configuration, chemical properties, and different compounds of p-block elements—which often confuse students. With the help of simple answers and step-by-step NCERT Solutions, learning becomes a lot easier and less scary.
You can download the free PDF solutions and use them anytime for revision or doubt-clearing. These solutions from Vedantu are especially helpful if you’re studying in Hindi medium or want clear explanations. For more help on topics and updated syllabus, check Class 12 Chemistry CBSE syllabus early in your preparation.
You’ll also find all the textbook questions with answers, helping you revise quickly before exams. These NCERT Solutions are handy for last-minute preparation and building your confidence for the boards. If you need more support, you can always access the complete NCERT Solutions for Class 12 Chemistry on our site.
Access NCERT Solutions for Class-12 Chemistry Chapter 7 – p-ब्लॉक के तत्त्व
1: वर्ग \[15\] के तत्वों के सामान्य गुणधर्मो की उनके इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था, परमाण्विक आकार, आयनन एन्थैल्पी तथा विद्युत ऋणात्मकता के सन्दर्भ में विवेचना कीजिए।
उत्तर:
इलेक्ट्रॉनिक विन्यास (Electronic configuration) – इन तत्वों के संयोजी कोश का इलेक्ट्रॉनिक विन्यास \[n{s^2},{\text{ }}n{p^3}\] होता है। इनमें \[s - \]कक्षक पूर्णतया भरे हुए तथा \[p - \] कक्षक अर्द्धपूरित होते हैं, जो इनके इलेक्ट्रॉनिक विन्यास को अधिक स्थायी बनाते हैं।
ऑक्सीकरण अवस्थाएँ (Oxidation states) – इन तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ \[ - 3, + 3\] तथा \[ + 5\] हैं। तत्वों द्वारा \[ - 3\] ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति वर्ग में नीचे जाने पर परमाणु आकार तथा धात्विक गुण बढ़ने के कारण घटती है। वस्तुतः अन्तिम तत्व बिस्मथ कठिनता से \[ - 3\] ऑक्सीकरण अवस्था में यौगिक बनाता है। ऑक्सीकरण अवस्था \[ + 5\] का स्थायित्व वर्ग में नीचे जाने पर घटता है। इस अवस्था में केवल \[Bi\left( V \right)\] का यौगिक \[Bi{F_5}\] ज्ञात है। ऑक्सीकरण अवस्था \[ + 5\] तथा ऑक्सीकरण अवस्था \[ + 3\] का स्थायित्व वर्ग में नीचे जाने पर क्रमशः घटता तथा बढ़ता है (अक्रिय युग्म प्रभाव)। नाइट्रोजन \[ + 1,{\text{ }} + 2,{\text{ }} + 4\] ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है, जबकि यह ऑक्सीजन के साथ अभिकृत होता है। फॉस्फोरस कुछ ऑक्सोअम्लों में \[ + 1\] तथा \[ + 4\] ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है।
परमाणु आकार (Atomic size) – समूह में नीचे जाने पर सहसंयोजी तथा आयनिक त्रिज्याएँ बढ़ती हैं। \[N\] से \[P\] तक सहसंयोजी त्रिज्याओं में पर्याप्त वृद्धि होती है, जबकि \[As\] से \[Bi\] तक सहसंयोजी त्रिज्याओं में सूक्ष्म वृद्धि प्रेक्षित होती है। यह भारी सदस्यों में पूर्णतया भरे हुए \[d\] तथा \[f - \]कक्षकों की उपस्थिति के कारण होता है।
आयनन एन्थैल्पी (Ionisation enthalpy) – वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी में परमाणु आकार में क्रमिक वृद्धि के कारण कमी आती है। इस प्रकार अधिक स्थायी अर्द्धपूरित \[p - \]कक्षक के इलेक्ट्रॉनिक विन्यास तथा छोटे आकार के कारण वर्ग \[15\] के तत्वों की आयनन एन्थैल्पी के मान वर्ग \[14\] के तत्वों से सम्बन्धित आवर्गों में अधिक होते हैं। आयनन एन्थैल्पी का उत्तरोत्तर बढ़ता क्रम निम्नवत् है – \[\Delta i{H_1} < {\text{ }}\Delta i{H_2} < {\text{ }}\Delta i{H_3}\]
विद्युत ऋणात्मकता (Electronegativity) – किसी समूह में नीचे जाने पर परमाणु आकार बढ़ने के साथ विद्युत ऋणात्मकता सामान्यतः घटती है। यद्यपि भारी तत्वों में इस प्रकार का कोई विशेष प्रभाव नहीं पड़ता है।
2: नाइट्रोजन की क्रियाशीलता फॉस्फोरस से भिन्न क्यों है?
उत्तर: \[{N_2}\] अणु में उपस्थित \[N \equiv N\] बन्ध की अत्यधिक बन्ध वियोजन एन्थैल्पी \[\left( {941.4{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right)\] के कारण नाइट्रोजन अणु फॉस्फोरस अणु की तुलना में बहुत कम क्रियाशील हैं। फॉस्फोरस अणु \[\left( {{P_4}} \right)\] में उपस्थित \[P - P\] बन्धों की बन्ध वियोजन एन्थैल्पी काफी कम \[\left( {201.6{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right)\] होती है।
3: वर्ग \[15\] के तत्वों की रासायनिक क्रियाशीलता की प्रवृत्ति की विवेचना कीजिए।
उत्तर:
हाइड्राइड (Hydrides) – वर्ग \[15\] के सभी तत्व \[M{H_3}\] तथा \[M{H_4}\] प्रकार के हाइड्राइड बनाते हैं। \[\left( {M = N,{\text{ }}P,{\text{ }}As,{\text{ }}Sb,{\text{ }}Bi} \right)\]। क्षारीय गुण (Basic character) – हाइड्राइडों के क्षारीय गुण उनके आकार बढ़ने अर्थात् इलेक्ट्रॉन घनत्व घटने के साथ घटते हैं।
ऊष्मीय स्थायित्व (Thermal stability) – वर्ग में नीचे जाने पर हाइड्राइडों का ऊष्मीय स्थायित्व घटता है क्योंकि परमाणु आकार बढ़ता है जिससे बन्ध लम्बाई \[\left( {M{\text{ }}--{\text{ }}H} \right)\] बढ़ती है।
अपचायक गुण (Reducing character) – यह वर्ग में नीचे जाने पर बढ़ता है क्योंकि स्थायित्व घटता है। \[N{H_3}\] के अतिरिक्त सभी प्रबल अपचायक होते हैं। क्वथनांक (Boiling point) – \[N{H_3}\] का क्वथनांक हाइड्रोजन आबन्ध के कारण \[P{H_3}\] से अधिक होता है। क्वथनांक \[P{H_3}\] से आगे जाने पर बढ़ते हैं क्योंकि आण्विक द्रव्यमान बढ़ने के कारण वान्डर वाल्स बलों में वृद्धि होती है। अभिक्रियाएँ –
$C{a_3}{P_2} + {\text{ }}6{H_2}O{\text{ }} \to {\text{ }}2P{H_3} \uparrow {\text{ }} + {\text{ }}3{\text{ }}Ca{\left( {OH} \right)_2}{P_4} + {\text{ }}3{\text{ }}KOH{\text{ }} + {\text{ }}3{H_2}O{\text{ }} \to {\text{ }}P{H_3} \uparrow {\text{ }} + {\text{ }}3{\text{ }}K{H_2}P{O_2}$
$2N{H_3} + {\text{ }}NaOCl{\text{ }} \to {\text{ }}{N_2}{H_4} + {\text{ }}NaCl{\text{ }} + {\text{ }}{H_2}{O_2}$
हैलाइड (Halides) :
(i) ट्राइहैलाइड (Trihalides) – ये सभी प्रकार के हैलोजेनों से सीधे संयोग करके \[M{X_3}\] प्रकार के ट्राइलाइड बनाते हैं। \[NB{r_3}\] तथा \[N{I_3}\] को छोड़कर सभी ट्राइहैलाइड स्थायी तथा पिरैमिडी संरचना के होते हैं। \[Bi{F_3}\] के अतिरिक्त सभी ट्राइहैलाइड सहसंयोजी प्रकृति के होते हैं। ट्राइहैलाइडों की सहसंयोजी प्रकृति तत्व के आकार के बढ़ने पर घटती है।
$N{F_3} > P{F_3} > {A_S}{F_3} > Sb{F_3} > Bi{F_3}$
ट्राइहैलाइड सरलता से जल-अपघटित हो जाते हैं –
${NC{l_3} + {\text{ }}3{H_2}O{\text{ }} \to {\text{ }}N{H_3} \uparrow {\text{ }} + {\text{ }}3{\text{ }}HOCl}$
${PC{l_3} + {\text{ }}3{H_2}O{\text{ }} \to {\text{ }}{H_3}P{O_3} + {\text{ }}3{\text{ }}HCl}$
${4{\text{ }}AsC{l_3} + {\text{ }}6{H_2}O{\text{ }} \to {\text{ }}A{s_4}{O_6} + {\text{ }}12{\text{ }}HCl}$
${SbC{l_3} + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}SbOCl{\text{ }} + {\text{ }}2{\text{ }}HCl}$
${BiC{l_3} + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}BiOCl{\text{ }} + {\text{ }}2{\text{ }}HCl}$
फॉस्फोरस तथा एण्टीमनी के ट्राइहैलाइड लूइस अम्ल की भाँति व्यवहार करते हैं।
${P{F_3} + {\text{ }}{F_2} \to {\text{ }}P{F_5}}$
${Sb{F_3} + {\text{ }}2{F^--} \to {\text{ }}{{\left[ {Sb{F_5}} \right]}^{2 - }}}$
(ii) पेन्टाहैलाइड (Pentahalides) – \[P,{\text{ }}As\] तथा \[Sb\] सूत्र \[MC{l_5}\] के पेन्टालाइड बनाते हैं। \[N\] पेन्टाहलाइड नहीं बनाता है; क्योंकि इलेक्ट्रॉन के उत्तेजन के लिए d-कक्षक अनुपस्थित होते हैं। \[Bi\] अक्रिय-युग्म प्रभाव के कारण पेन्टाहैलाइड नहीं बनाता। पेन्टाक्लोराइडों में \[s{p^3}\] संकरण होता है तथा इनकी संरचना त्रिकोणीय द्विपिरैमिडी होती है।
3. ऑक्साइड (Oxides) – ये ऑक्सीजन से प्रत्यक्ष या अप्रत्यक्ष रूप से जुड़कर अधिक संख्या में ऑक्साइड बनाते हैं।
नाइट्रोजन के ऑक्साइड (Oxides of nitrogen) – नाइट्रोजन ऑक्सीजन के साथ क्रिया करके कई प्रकार के ऑक्साइड बनाता है। इनका संक्षिप्त वर्णन निम्नांकित रूप में तालिकाबद्ध है –
फॉस्फोरस के ऑक्साइड (Oxides of phosphorus) – फॉस्फोरस के दो महत्त्वपूर्ण ऑक्साइड \[{P_4}{O_6}({P_2}{O_3}\] का द्विलक) तथा \[{P_4}{O_{10}}({P_2}{O_5}\] का द्विलक) हैं। इन्हें अग्रवत् प्राप्त किया जाता है –
$P4 + 6O\xrightarrow{\Delta }P4O6$
$P4 + 5O2 \to P4O10$
(iii) अन्य तत्वों के ऑक्साइड (Oxides of other elements) – \[A{s_4}{O_6},{\text{ }}A{s_2}{O_5},{\text{ }}S{b_4}{O_6},{\text{ }}S{b_2}{O_5},{\text{ }}B{i_2}{O_3}\] तथा \[B{i_2}{O_5}\]. \[N,{\text{ }}P\] तथा \[As\] के ट्राइऑक्साइड अम्लीय होते हैं। अम्लीय गुण वर्ग में नीचे जाने पर घटता है। \[Sb\] का ऑक्साइड उभयधर्मी होता है, जबकि \[Bi\] का ऑक्साइड क्षारीय होता है। सभी पेन्टाऑक्साइड अम्लीय होते हैं। \[{N_2}{O_5}\] प्रबलतम तथा \[B{i_2}{O_5}\] दुर्बलतम अम्लीय ऑक्साइड होता है। \[\left( 4 \right)\] ऑक्सी-अम्ल (Oxy-acids) – \[Bi\] को छोड़कर अन्य सभी तत्व ऑक्सी-अम्लों (जैसे- \[HN{O_3},{\text{ }}{H_3}P{O_4},{\text{ }}{H_3}As{O_4}\], तथा \[{H_2}Sb{O_4}\]) का निर्माण करते हैं। ऑक्सी-अम्लों का सामर्थ्य तथा स्थायित्व वर्ग में नीचे जाने पर घटता है।
$HN{O_3} > {H_3}P{O_4} > {H_3}As{O_4} > {H_3}Sb{O_4}$
4: \[N{H_3}\] हाइड्रोजन बन्ध बनाती है, परन्तु \[P{H_3}\] नहीं बनाती, क्यों?
उत्तर: नाइट्रोजन की विद्युत ऋणात्मकता \[\left( {3:{\text{ }}0} \right)\] हाइड्रोजन \[\left( {2{\text{ }}:{\text{ }}1} \right)\] से अधिक होती है। अत: \[N{\text{ }}--{\text{ }}H\] आबन्ध ध्रुवीय होता है। इसलिए \[N{H_3}\] में अन्तराआण्विक हाइड्रोजन आबन्ध होते हैं। इसके विपरीत \[P\] तथा \[H\] दोनों की विद्युत ऋणात्मकता \[2{\text{ }}:{\text{ }}1\] होती है, इसलिए \[PH\] बन्ध ध्रुवीय नहीं होता, अत: इसमें हाइड्रोजन बन्ध नहीं होता है।
5: प्रयोगशाला में नाइट्रोजन कैसे बनाते हैं? सम्पन्न होने वाली अभिक्रिया के रासायनिक समीकरणों को लिखिए।
उत्तर: प्रयोगशाला में अमोनियम क्लोराइड के सममोलर जलीय विलयन की सोडियम नाइट्राइट के साथ अभिक्रिया से नाइट्रोजन बनाते हैं। इस अभिक्रिया में द्विअपघटन के परिणामस्वरूप अमोनियम नाइट्राइट बनता है जो अस्थायी होने के कारण अपघटित होकर डाइनाइट्रोजन गैस बनाता है।
\[N{H_4}Cl\left( {aq} \right){\text{ }} + {\text{ }}NaN{O_2}\left( {aq} \right){\text{ }} \to {\text{ }}N{H_4}N{O_2}\left( {aq} \right){\text{ }} + {\text{ }}NaCl{\text{ }}\left( {aq} \right)\]
6: अमोनिया का औद्योगिक उत्पादन कैसे किया जाता है?
उत्तर: अमोनिया का औद्योगिक उत्पादन हेबर प्रक्रम से किया जाता है। \[N2(g) + 3H2(g) \rightleftharpoons 2NH3(g),{\Delta _f}{H^ - } = - 46.1kJmol - 1\] शुष्क नाइट्रोजन तथा हाइड्रोजन को \[1:3\] में लेकर उच्च दाब (\[200\] से \[300\] वायुमण्डल) तथा ताप । (\[723{\text{ }}K\] से \[773{\text{ }}K\]) पर \[A{l_2}{O_3}\] मिश्रित आयरन उत्प्रेरक पर प्रवाहित करने पर \[N{H_3}\] प्राप्त होती है। जिसे द्रवित करके तरल रूप में प्राप्त कर लेते हैं।
7: उदाहरण देकर समझाइए कि कॉपर धातु HNO3 के साथ अभिक्रिया करके किस प्रकार भिन्न उत्पाद दे सकती है?
उत्तर: तनु \[HNO_3^ - \] कॉपर के साथ अभिक्रिया करके कॉपर नाइट्रेट तथा नाइट्रिक ऑक्साइड बनाता है, जबकि सान्द्र \[HN{O_3}\] कॉपर के साथ अभिक्रिया करके कॉपर नाइट्रेट तथा नाइट्रोजन डाइऑक्साइड बनाता है।
8: \[N{O_2}\] तथा \[{N_2}{O_5}\] की अनुनादी संरचनाओं को लिखिए।
उत्तर: (i) \[N{O_2}\] की अनुनादी संरचनाएँ –
(image will be uploaded soon)
(ii) \[{N_2}{O_5}\] की अनुनादी संरचनाएँ –
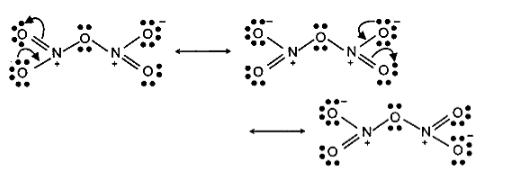
9: \[HNH\] कोण का मान, \[HPH,{\text{ }}HAsH\] तथा \[HSbH\] कोणों की अपेक्षा अधिक क्यों होता है? (संकेत- \[N{H_3}\] में \[s{p^3}\] संकरण के आधार तथा हाइड्रोजन और वर्ग के दूसरे तत्वों के बीच केवल \[s - p\] आबंधन के द्वारा व्याख्या की जा सकती है।)
उत्तर: \[M{H_3}\] प्रकार के हाइड्राइडों में केन्द्रीय परमाणु \[M\] इलेक्ट्रॉनों के तीन बन्ध युग्मों (bond pairs) तथा एक एकल युग्म (lone pair) से निम्न प्रकार से घिरा रहता है –
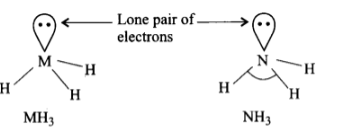
नाइट्रोजन परमाणु का आकार में बहुत छोटे तथा अधिक विद्युत ऋणात्मक होने के कारण \[N{H_3}\] में \[N\] परमाणु पर इलेक्ट्रॉन घनत्व का मान अधिकतम होता है। इस कारण बन्ध युग्मों के मध्य अधिकतम प्रतिकर्षण होता है और इस कारण \[HNH\] बन्ध कोण का मान अधिकतम होता है। परमाणु आकार में वृद्धि होने के कारण \[N\] से \[Bi\] की ओर जाने पर \[M\] की विद्युत ऋणात्मकता घटती है। फलस्वरूप इलेक्ट्रॉन युग्मों के मध्य प्रतिकर्षण कम हो जाता है। यही कारण है कि \[N{H_3}\] से \[Bi{H_3}\] की ओर जाने पर \[H - M - H\] बन्ध कोण घटता है।
10: \[{R_3}P{\text{ }} = {\text{ }}O\] पाया जाता है जबकि \[{R_3}N{\text{ }} = {\text{ }}O\] नहीं, क्यों (\[R{\text{ }} = \] ऐल्किल समूह)?
उत्तर: \[d - \]ऑर्बिटलों की अनुपस्थिति के कारण, \[N\] अपनी सहसंयोजकता को \[4\] से अधिक करने में और \[d\pi {\text{ }}--{\text{ }}p\pi \] बन्धों का निर्माण करने में असमर्थ है। इस कारण, यह \[{R_3}N{\text{ }} = {\text{ }}O\] प्रकार के यौगिकों का निर्माण नहीं करता है। इसके विपरीत \[P\] के पास \[d - \]ऑर्बिटल होते हैं और यह \[d\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्ध बनाने में सक्षम है। अत: यह अपनी सहसंयोजकता को \[5\] तक बढ़ाकर \[{R_3}P{\text{ }} = {\text{ }}O\] प्रकार के यौगिक बनाता है।
11: समझाइए कि क्यों \[N{H_3}\] क्षारकीय है, जबकि BiH3 केवल दुर्बल क्षारक है?
उत्तर: \[N\] परमाणु का आकार \[\left( {70{\text{ }}pm} \right),{\text{ }}Bi\] के परमाणु आकार \[\left( {148{\text{ }}pm} \right)\] की तुलना में काफी कम है। इस कारण \[N{H_3}\] में \[N\] परमाणु पर इलेक्ट्रॉन घनत्व का मान \[Bi{H_3}\] में \[Bi\] पर इलेक्ट्रॉन घनत्व के मान से काफी अधिक होता है। इस कारण \[Bi{H_3}\] की तुलना में \[N{H_3}\] अधिक प्रभावशाली ढंग से इलेक्ट्रॉनों के एकल युग्म को दे सकता है। यही कारण है कि \[Bi{H_3}\] की तुलना में \[N{H_3}\] अधिक क्षारीय है।
12: नाइट्रोजन द्विपरमाणुक अणु के रूप में पाया जाता है तथा फॉस्फोरस \[{P_4}\] के रूप में, क्यों?
उत्तर: छोटे परमाणु आकार तथा अधिक विद्युत ऋणात्मकता के कारण नाइट्रोजन में स्वयं से \[p\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्धों को बनाने की प्रबल प्रवृत्ति होती है। इस प्रकार, यह \[N{\text{ }} \equiv {\text{ }}N\] बन्ध का निर्माण कर एक द्वि-परमाणविक अणु \[\left( {{N_2}} \right)\] के रूप में पाया जाता है। इसके विपरीत, बड़े परमाणु आकार तथा कम विद्युत ऋणात्मकता के कारण फॉस्फोरस में स्वयं से \[p\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्धों को बनाने की प्रवृत्ति नहीं होती है। अत: यह \[P{\text{ }}--{\text{ }}P\] एकल बन्धों को बनाकर एक समचतुष्फलकीय \[{P_4}\] अणु का निर्माण करता है।
13: श्वेत फॉस्फोरस तथा लाल फॉस्फोरस के गुणों की मुख्य भिन्नताओं को लिखिए।
उत्तर: श्वेत फॉस्फोरस तथा लाल फॉस्फोरस के गुणों की मुख्य भिन्नताएँ निम्नलिखित हैं –
क्र. सं. | गुण | श्वेत फॉस्फोरस | लाल फॉस्फोरस |
\[1\] | अवस्था | मोमीय ठोस | भंगुर पदार्थ |
\[2\] | रंग | श्वेत, प्रकाश में रखने पर पीला पड़ जाता है। | लाल |
\[3\] | गंध | लहसुन जैसी गन्ध | गन्धहीन |
\[4\] | कठोरता | मोम जैसा मृदु तथा चाकू से काटा जा सकता है। | कठोर |
\[5\] | विषैली प्रकृति | विषैला | विषैला नहीं होता। |
\[6\] | विलेयता | ${\text{C}}{{\text{S}}_2}$ में विलेय | ${\text{C}}{{\text{S}}_2}$ में अविलेय |
\[7\] | गलनांक | $317\;{\text{K}}$ | $563\;{\text{K}}$ पर ऊर्ध्वपातित हो जाता है तथा \[43\] वायुमण्डलीय दाब एवं $862\;{\text{K}}$ पर पिघल जाता है। |
श्वेत तथा लाल फॉस्फोरस की संरचनाएँ निम्नवत् होती हैं –
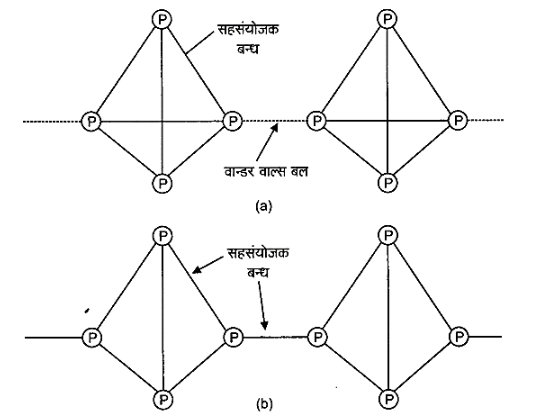
14: फॉस्फोरस की तुलना में नाइट्रोजन श्रृंखलन गुणों को कम प्रदर्शित करती है, क्यों?
उत्तर: शृंखलन का गुण तत्व की बन्ध प्रबलता पर निर्भर करता है। चूंकि \[N - N\] बन्ध की प्रबलता \[\left( {159{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right),{\text{ }}P - P\] बन्ध की प्रबलता \[\left( {212{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right)\] से कम होती है, इसलिए नाइट्रोजन फॉस्फोरस की तुलना में कम श्रृंखलन गुणों को दर्शाती है।
15: \[{H_3}P{O_3}\] की असमानुपातन अभिक्रिया दीजिए।
उत्तर: गर्म किये जाने पर \[{H_3}P{O_3}\] निम्न प्रकार से असमानुपातन प्रदर्शित करता है –
\[4{H^{ + 3}}_3P{O_3}\xrightarrow{\Delta }P{H^{ - 3}}_3 + 3{H_3}P{O_4}\]
16: क्या \[PC{l_5}\] ऑक्सीकारक और अपचायक दोनों का कार्य कर सकता है? तर्क दीजिए।
उत्तर: \[PC{l_5}\] में \[P\] की ऑक्सीकरण अवस्था \[ + 5\] है जो \[P\] की उच्चतम ऑक्सीकरण अवस्था है। अतः, यह अपनी ऑक्सीकरण अवस्था को \[ + 5\] से अधिक प्रदर्शित नहीं कर सकता है, अर्थात् इसे और अधिक ऑक्सीकृत नहीं किया जा सकता है। इस प्रकार यह अपचायक की भाँति व्यवहार नहीं कर सकता है। इसके विपरीत, यह आसानी से एक ऑक्सीकारक की भाँति व्यवहार कर सकता है क्योंकि यह अपनी ऑक्सीकरण अवस्था को \[ + 5\] से घटाकर \[ + 3\] कर सकता है।
$PC{l_5} + {H_2} \to PC{l_3} + HCl$
$PC{l_5} + Zn \to PC{l_3} + ZnC{l_2}$
17: \[O,{\text{ }}Se,{\text{ }}Te\] तथा \[Po\] को इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था तथा हाइड्राइड निर्माण के सन्दर्भ में आवर्त सारणी के एक ही वर्ग में रखने का तर्क दीजिए।
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration)- इन सभी तत्वों का संयोजी कोश इलेक्ट्रॉनिक विन्यास समान, \[n{s^2}n{p^2}(n{\text{ }} = {\text{ }}2\] से \[6\] तक) होता है। इससे इन तत्वों को आवर्त सारणी के वर्ग \[16\] में रखा जाना चरितार्थ होता है।
${\;_8}O\;\; = \left[ {He} \right]2{s^2}2{p^4}\;$
${\;_{16}}\;S\;\; = \left[ {Ne} \right]3{s^2}3{p^4}\;$
${\;_{34}}Se\;\; = \left[ {Ar} \right]3{d^{10}}4{s^2}4{p^4}\;$
${\;_{52}}Te\;\; = \left[ {Kr} \right]4{d^{10}}5{s^2}5{p^4}\;$
${\;_{84}}Po\;\; = \left[ {Xe} \right]4{f^{14}}5{d^{10}}6{s^2}6{p^4}\;$
(ii) ऑक्सीकरण अवस्था (Oxidation state) – इन्हें समीपवर्ती अक्रिय गैस विन्यास प्राप्त करने के लिए अर्थात् द्विऋणात्मक आयन बनाने के लिए दो अतिरिक्त इलेक्ट्रॉनों की आवश्यकता पड़ती है, इसलिए इन तत्वों की न्यूनतम ऑक्सीकरण अवस्था \[ - 2\] होनी चाहिए। ऑक्सीजन विशिष्ट रूप से तथा सल्फर कुछ मात्रा में विद्युत ऋणात्मक होने के कारण \[ - 2\] ऑक्सीकरण अवस्था प्रदर्शित करते हैं। इस वर्ग के अन्य तत्व, \[O\] तथा \[S\] से अधिक विद्युत ऋणात्मक होने के कारण ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करते हैं। चूंकि इन तत्वों के संयोजी कोश में \[6\] इलेक्ट्रॉन होते हैं, इसलिए ये तत्व अधिकतम \[ + 6\] ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं। इन तत्वों द्वारा प्रदर्शित अन्य धनात्मक ऑक्सीकरण अवस्थाएँ \[ + 2\] तथा \[ + 4\] हैं। यद्यपि ऑक्सीजन \[4 - \]कक्षकों की अनुपस्थिति के कारण \[ + 4\] तथा \[ + 6\] ऑक्सीकरण अवस्थाएँ प्रदर्शित नहीं करता, अतः न्यूनतम तथा अधिकतम ऑक्सीकरण अवस्थाओं के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग \[16\] में रखा जाना पूर्णतया न्यायोचित है।
(iii) हाइड्राइडों का निर्माण (Formation of hydrides) – सभी तत्व अपने संयोजी इलेक्ट्रॉनों में से दो इलेक्ट्रॉनों की हाइड्रोजन के \[1s - \] कक्षक के साथ सहभागिता करके अपने-अपने अष्टक पूर्ण कर लेते हैं। तथा सामान्य सूत्र \[EH\], के हाइड्राइड बनाते हैं; जैसे- \[{H_2}O,{\text{ }}{H_2}S,{\text{ }}{H_2}Se,{\text{ }}{H_2}Te\] तथा \[{H_2}Po\], इसलिए सामान्य सूत्र EH2 वाले हाइड्राइड बनाने के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग \[16\] में रखा जाना पूर्णतया न्यायोचित है।
18: क्यों डाइऑक्सीजन एक गैस है, जबकि सल्फर एक ठोस है?
उत्तर:
ऑक्सीजन \[p\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्ध बनाता है। छोटे आकार तथा उच्च विद्युत ऋणात्मकता के कारण ऑक्सीजन द्विपरमाणुक अणु (\[{O_2}\]) के रूप में पाया जाता है। ये अणु परस्पर दुर्बल वाण्डर वाल्स आकर्षण बलों द्वारा जुड़े रहते हैं जो कमरे के ताप पर अणुओं के संघट्टों द्वारा सरलता से हट जाते हैं। अत: \[{O_2}\] कमरे के ताप पर एक गैस होती है। सल्फर अपने विशाल आकार तथा कम विद्युत ऋणात्मकता के कारण \[p\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्ध नहीं बनाता है, अपितु यह \[S{\text{ }}--{\text{ }}S\] एकल बन्ध बनाते हैं। पुनः \[O{\text{ }}--{\text{ }}O\] एकल बन्धों से अधिक प्रबल \[S{\text{ }}--{\text{ }}S\] बन्धों के कारण सल्फर में श्रृंखलन का गुण ऑक्सीजन से अधिक होता है। अत: सल्फर श्रृंखलन की उच्च प्रवृत्ति तथा \[p\pi {\text{ }}--{\text{ }}p\pi \] बहुल बन्ध बनाने की अल्प प्रवृत्ति के कारण अष्टपरमाणुक अणु (\[{S_8}\]) बनाता है जिसकी संकुचित वलय संरचना (puckered ring structure) होती है। विशाल आकार के कारण \[{S_8}\] अणुओं को परस्पर बाँधे रखने वाले आकर्षण बल पर्याप्त प्रबल होते हैं जिन्हें कमरे के ताप पर अणुओं के संघट्टों द्वारा नहीं हटाया जा सकता है। अत: सल्फर कमरे के ताप पर एक ठोस होता है।
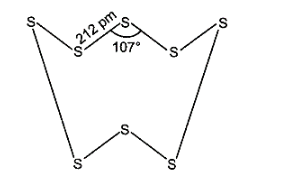
19: यदि \[O{\text{ }} \to {\text{ }}{O^--}\] तथा \[O{\text{ }} \to {\text{ }}O_2^ - \] के इलेक्ट्रॉन लब्धि एन्थैल्पी मान पता हों, जो क्रमशः \[141\] तथा \[702{\text{ }}kJ{\text{ }}mo{l^{ - 1}}\]हैं तो आप कैसे स्पष्ट कर सकते हैं कि \[O_2^ - \] स्पीशीज वाले ऑक्साइड अधिक बनते हैं न कि \[{O^--}\] वाले? (संकेत-यौगिकों के बनने में जालक ऊर्जा कारक को ध्यान में रखिए।)
उत्तर: \[O_2^ - \] मूलक युक्त ऑक्साइडों (अर्थात् \[MO\] प्रकार के ऑक्साइड) की जालक ऊर्जा (lattice energy) का मान \[O_2^ - \] मूलक युक्त ऑक्साइडों (अर्थात् \[{M_2}O\] प्रकार के ऑक्साइड) की जालक ऊर्जाओं से काफी अधिक होता है क्योंकि \[O_2^ - \] तथा \[{M^{2 + }}\] पर आवेश की मात्रा अधिक होती है। इसलिए \[O{\text{ }} \to {\text{ }}O_2^ - \] की इलेक्ट्रॉन लब्धि एन्थैल्पी का मान \[O{\text{ }} \to {\text{ }}{O^--}\] के सम्बन्धित मान की तुलना में काफी अधिक होने के बाद भी \[MO\] का निर्माण \[{M_2}O\] के निर्माण की तुलना में ऊर्जा की दृष्टि से अधिक सम्भाव्य है। यही कारण है कि \[MO\] प्रकार के ऑक्साइडों की संख्या \[{M_2}O\] प्रकार के ऑक्साइडों की तुलना में काफी अधिक है।
20: कौन-से ऐरोसॉल्स ओजोन को कम करते हैं?
उत्तर: क्लोरोफ्लोरोकार्बन (\[CFC\]) ऐरोसॉल जैसे-फ्रियोन (\[CC{l_2}{F_2}\]) वायुमण्डल के स्ट्रेटोस्फियर : (stratosphere) में उपस्थित ओजोन पर्त को विच्छेदित करते हैं। निहित अभिक्रियाएँ निम्न हैं –
$\mathrm{CF}_{2} \mathrm{Cl}_{2}+\mathrm{hv} \rightarrow \mathrm{CF}_{2} \mathrm{Cl}+\mathrm{Cl}$
Freon
$\mathrm{Cl}^{\cdot}+\mathrm{O}_{3} \rightarrow$ $\mathrm{ClO}+\mathrm{O}_{2}$
$\mathrm{ClO}+\mathrm{O} \rightarrow$ $\mathrm{Cl}+\mathrm{O}_{2}$
21: संस्पर्श प्रक्रम द्वारा \[{H_2}S{O_4}\] के उत्पादन का वर्णन कीजिए।
उत्तर: संस्पर्श विधि द्वारा \[{H_2}S{O_4}\] का उत्पादन (Production of \[{H_2}S{O_4}\] by Contact Process) सल्फ्यूरिक अम्ल का उत्पादन संस्पर्श प्रक्रम द्वारा तीन चरणों में सम्पन्न होता है।
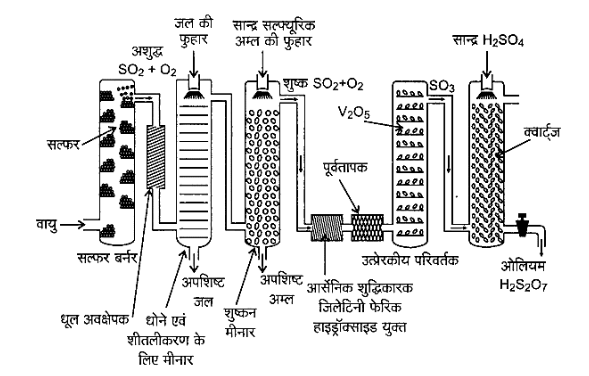
सल्फर अथवा सल्फाइड अयस्कों को वायु में जलाकर सल्फर डाइऑक्साइड का उत्पादन करना। उत्प्रेरक (\[{V_2}{O_5}\]) की उपस्थिति में ऑक्सीजन के साथ अभिक्रिया कराकर \[S{O_2}\] का \[S{O_3}\] में परिवर्तन करना। \[S{O_3}\] को सल्फ्यूरिक अम्ल में अवशोषित करके ओलियम (\[{H_2}{S_2}{O_7}\]) प्राप्त करना। सल्फ्यूरिक अम्ल के उत्पादन का प्रवाह चित्र, चित्र-7 में दिया गया है। प्राप्त सल्फर डाइऑक्साइड को धूल के कणों एवं आर्सेनिक यौगिकों जैसी अन्य अशुद्धियों से मुक्त कर शुद्ध कर लिया जाता है। सल्फ्यूरिक अम्ल के उत्पादन में ऑक्सीजन द्वारा \[S{O_2}\] गैस का \[{V_2}{O_5}\] उत्प्रेरक की उपस्थिति में \[S{O_3}\] प्राप्त करने के लिए उत्प्रेरकी ऑक्सीकरण मूल पद है।
$2S{O_2}\left( g \right) + {O_2}\left( g \right)\overset {^{{V_2}{O_5}}} \leftrightarrows \;2S{O_3}\left( g \right);\;{\Delta _r}{H^ \ominus } = - 196.6\;kJ\;mo{l^{ - 1}}$
यह अभिक्रिया ऊष्माक्षेपी तथा उत्क्रमणीय है एवं अग्र अभिक्रिया में आयतन में कमी आती है। अतः कम ताप और उच्च दाब उच्च लब्धि (yield) के लिए उपयुक्त स्थितियाँ हैं, परन्तु तापक्रम बहुत कम नहीं होना चाहिए अन्यथा अभिक्रिया की गति धीमी हो जाएगी। सल्फ्यूरिक अम्ल के उत्पादन में प्रयुक्त संयन्त्र का संचालन \[2{\text{ }}bar\] दाब तथा \[720{\text{ }}K\] ताप पर किया जाता है। उत्प्रेरकी परिवर्तक से प्राप्त \[S{O_3}\] गैस, सान्द्र सल्फ्यूरिक अम्ल,में अवशोषित होकर ओलियम (\[{H_2}{S_2}{O_7}\]) बना देती है। जल द्वारा ओलियम का तनुकरण करके वांछित सान्द्रता वाला सल्फ्यूरिक अम्ल प्राप्त कर लिया जाता है। प्रक्रम के सतत संचालन तथा लागत में भी कमी लाने के लिए उद्योग में उपर्युक्त दोनों प्रक्रियाएँ साथ-साथ सम्पन्न की जाती हैं।
${S{O_3} + {\text{ }}{H_2}S{O_4} \to {\text{ }}{H_2}{S_2}{O_7}}$
${{H_2}{S_2}{O_7} + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}2{\text{ }}{H_2}S{O_4}}$
संस्पर्श विधि द्वारा सल्फ्यूरिक अम्ल की शुद्धता सामान्यतः \[96{\text{ }}--{\text{ }}98\% \] होती है।
22: \[S{O_2}\] किस प्रकार से एक वायु प्रदूषक है?
उत्तर: \[S{O_2}\] एक अत्यन्त हानिकारक गैस है। वायुमण्डल में इसकी उपस्थिति से श्वसन रोग, हृदय रोग, गले तथा आँखों में अनेक परेशानियाँ उत्पन्न होती हैं। यह अम्ल वर्षा (acid rain) का मुख्य कारण है। अम्ल वर्षा जन्तुओं, वनस्पतियों एवं भवनों के लिए अत्यन्त घातक है। अम्ल वर्षा से सम्बन्धित प्रकाश-रासायनिक अभिक्रियाएँ निम्न हैं –
${S{O_2} + {\text{ }}hv{\text{ }} \to {\text{ }}S{O_2}}$
${S{O_2} + {\text{ }}{O_2} \to {\text{ }}S{O_3} + {\text{ }}O}$
${S{O_2} + {\text{ }}S{O_2} \to {\text{ }}S{O_3} + {\text{ }}SO}$
${SO{\text{ }} + {\text{ }}S{O_2} \to {\text{ }}S{O_3} + {\text{ }}S}$
${SO{\text{ }} + {\text{ }}{H_2}O{\text{ }} \to {\text{ }}{H_2}S{O_4}}$
इस प्रकार, \[S{O_2}\] एक घातक वायु प्रदूषक है।
23: हैलोजेन प्रबल ऑक्सीकारक क्यों होते हैं?
उत्तर: हैलोजेनों में अल्प आबन्ध वियोजन एन्थैल्पी, उच्च विद्युत ऋणात्मकता तथा अधिक ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी के कारण इलेक्ट्रॉन ग्रहण करके अपचयित होने की प्रबल प्रवृत्ति होती है।
\[X{\text{ }} + {\text{ }}{e^--} \to {\text{ }}{X^--}\]
अत: हैलोजेन प्रबल ऑक्सीकरण कर्मक या ऑक्सीकारक होते हैं। यद्यपि इनकी ऑक्सीकारक क्षमता \[{F_2}\] से \[{I_2}\] तक घटती है जैसा कि इनके इलेक्ट्रोड विभवों से सत्यापित होता है –
$E_{{F_2}/{F^ - }}^ \ominus \; = + 2.87\;V\;$
$E_{C{l_2}/C{l^ - }}^ \ominus \; = + 1.36\;V\;$
$E_{B{r_2}/B{r^ - }}^ \ominus \; = + 1.09\;V\;$
$E_{{I_2}/{I^ - }}^ \ominus \; = + 0.54\;V\;$
इसलिए \[{F_2}\] प्रबलतम तथा \[{I_2}\] दुर्बलतम ऑक्सीकारक होता है।
24: स्पष्ट कीजिए कि फ्लुओरीन केवल एक ही ऑक्सो-अम्ल, \[HOF\] क्यों बनाता है?
उत्तर: फ्लोरीन सर्वाधिक विद्युत ऋणात्मक तत्त्व है और केवल \[ - 1\] ऑक्सीकरण अवस्था ही प्राप्त कर सकती है। इसका परमाणु आकार भी काफी कम होता है। इस कारण यह उच्च ऑक्सी अम्लों जैसे- \[HOXO,{\text{ }}HOX{O_2}\] तथा \[HOX{O_3}\] आदि में केन्द्रीय परमाणु के रूप में स्थित नहीं हो पाती है और केवल एक ही ऑक्सी अम्ल \[HOF\] का निर्माण करती है। इस अम्ल में इसकी ऑक्सीकरण अवस्था \[ - 1\] है।
25: व्याख्या कीजिए कि क्यों लगभग एकसमान विद्युत ऋणात्मकता होने के पश्चात् भी नाइट्रोजन हाइड्रोजन आबन्ध निर्मित करता है, जबकि क्लोरीन नहीं।
उत्तर: यद्यपि \[O\] तथा \[Cl\] दोनों की विद्युत ऋणात्मकताओं के मान लगभग समान हैं, तथापि उनके परमाणु आकार काफी भिन्न होते हैं \[\left( {O{\text{ }} = {\text{ }}66{\text{ }}pm,{\text{ }}Cl{\text{ }} = {\text{ }}99{\text{ }}pm} \right)\]। इस कारण \[Cl\] परमाणु की तुलना में \[O\] परमाणु पर इलेक्ट्रॉन घनत्व का मान काफी अधिक होता है। इस कारण ही ऑक्सीजन तो हाइड्रोजन बन्ध बनाने में सक्षम है, लेकिन \[Cl\] नहीं।
26: \[Cl{O_2}\] के दो उपयोग लिखिए।
उत्तर: \[Cl{O_2}\] एक शक्तिशाली ऑक्सीकारक तथा क्लोरीनीकारक है। अत: इसका उपयोग जल के शुद्धीकरण में किया जाता है। यह एक उत्कृष्ट विरंजक (bleaching agent) है और इसका उपयोग कागज की लुगदी तथा वस्त्रों के विरंजन में किया जाता है।
27: हैलोजेन रंगीन क्यों होते हैं?
उत्तर: सभी हैलोजेन रंगीन होते हैं। इसका कारण यह है कि इनके अणु दृश्य क्षेत्र में प्रकाश अवशोषित कर लेते हैं जिसके फलस्वरूप इनके इलेक्ट्रॉन उत्तेजित होकर उच्च ऊर्जा स्तरों में चले जाते हैं, जबकि शेष प्रकाश उत्सर्जित हो जाता है। हैलोजेनों का रंग वास्तव में इस उत्सर्जित प्रकाश का रंग होता है। उत्तेजन के लिए आवश्यक ऊर्जा की मात्रा परमाणु आकार के अनुसार \[F\] से \[I\] तक लगातार घटती है, अतः उत्सर्जित प्रकाश की ऊर्जा \[F\] से \[F\] तक बढ़ती है। दूसरे शब्दों में, हैलोजेन का रंग \[{F_2}\] से \[{I_2}\] तक गहरा होता जाता है। उदाहरणार्थ– \[{F_2}\] बैंगनी प्रकाश अवशोषित करके हल्का पीला दिखाई देता है, जबकि आयोडीन पीला तथा हरा प्रकाश अवशोषित करके गहरा बैंगनी रंग का प्रतीत होता है। इसी प्रकार हम \[C{l_2}\] के हरे-पीले तथा ब्रोमीन के नारंगी-लाल रंग की व्याख्या कर सकते हैं।
28: जल के साथ \[{F_2}\] तथा \[C{l_2}\] की अभिक्रियाएँ लिखिए।
उत्तर: प्रबल ऑक्सीकारक होने के कारण \[F\], जल को \[0\], या \[0\]; में ऑक्सीकृत कर देता है।
\[\begin{array}{*{20}{l}}
{2{F_2}\left( g \right){\text{ }} + {\text{ }}2{H_2}O{\text{ }}\left( l \right){\text{ }} \to {\text{ }}4HF{\text{ }}\left( {aq} \right){\text{ }} + {\text{ }}{O_2}\left( g \right)} \\
{3{F_2}\left( g \right){\text{ }} + {\text{ }}3{H_2}O{\text{ }}\left( l \right){\text{ }} \to {\text{ }}6HF{\text{ }}\left( {aq} \right){\text{ }} + {\text{ }}{O_3}\left( g \right)}
\end{array}\]
\[C{l_2}\] जल से क्रिया कर हाइड्रोक्लोरिक तथा हाइपोक्लोरस अम्लों का निर्माण करता है।
$C{l_2}\left( g \right) + {H_2}O\left( l \right) \to HCl\left( {aq} \right) + \;HOCl\left( {aq} \right)\;\;\;\;$
हाइड्रोक्लोरिक अम्ल हाइपोक्लोरस अम्ल
29: आप \[HCl\] से \[C{l_2}\] तथा \[C{l_2}\] से \[HCl\] को कैसे प्राप्त करेंगे? केवल अभिक्रियाएँ लिखिए।
उत्तर: \[HCl\] से \[C{l_2}\]: \[Mn{O_2}\left( s \right){\text{ }} + {\text{ }}4HCl{\text{ }}\left( {aq} \right){\text{ }} \to {\text{ }}MnC{l_2}\left( {aq} \right){\text{ }} + {\text{ }}2{H_2}O{\text{ }}\left( l \right){\text{ }} + {\text{ }}C{l_2}\left( g \right)\]
\[C{l_2}\] से \[HCl\]: \[C{l_2}\left( g \right){\text{ }} + {\text{ }}{H_2}\left( g \right){\text{ }} \to {\text{ }}2HCl{\text{ }}\left( g \right)\]
30: एन-बार्टलेट \[Xe\] तथा \[Pt{F_6}\] के बीच अभिक्रिया कराने के लिए कैसे प्रेरित हुए?
उत्तर: नील बार्टलेट ने प्रेक्षित किया कि \[Pt{F_6}\] की अभिक्रिया \[{O_2}\] से होने पर एक आयनिक ठोस \[{O^{ + 2}}PtF{6^ - }\] प्राप्त होता है। \[{O_2}\left( g \right){\text{ }} + {\text{ }}Pt{F_6}\left( g \right){\text{ }} \to {\text{ }}{O^{ + 2}}{\left[ {Pt{F_6}} \right]^--}\] यहाँ \[{O_2}\], \[Pt{F_6}\] द्वारा O+2 में ऑक्सीकृत हो जाता है। बार्टलेट ने पाया कि \[Xe\] की प्रथम आयनन एन्थैल्पी \[\left( {1170{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right){\text{ }}{O_2}\] अणुओं की प्रथम आयनन एन्थैल्पी \[\left( {1175{\text{ }}kJ{\text{ }}mo{l^{ - 1}}} \right)\] के लगभग समान है, इसलिए \[Pt{F_6}\] द्वारा \[Xe\] को Xe+ में ऑक्सीकृत करना चाहिए। इस प्रकार वे \[Xe\] तथा \[Pt{F_6}\] के बीच अभिक्रिया कराने के लिए प्रेरित हुए। जब Xe तथा PtF6 को मिश्रित किया गया, तब एक तीव्र अभिक्रिया हुई तथा सूत्र \[X{e^ + }PtF{6^ - }\] का एक लाल ठोस पदार्थ प्राप्त हुआ। \[Xe{\text{ }} + {\text{ }}Pt{F_6}{\text{ }}\xrightarrow{{\left\{ {{\text{ }}278K{\text{ }}} \right\}}}{\text{X}}{e^ + }{\left[ {Pt{F_6}} \right]^--}\]
31. निम्नलिखित में फॉस्फोरस की ऑक्सीकरण अवस्थाएँ क्या हैं?
(i) \[{H_2}P{O_2}\]
उत्तर: $\;{H_3}P{O_3}\;\;\;\;\;\;\;\left( { + 1} \right) \times 3 + x + \left( { - 2} \right) \times 3 = 0$; या $x = + 3$
(ii) \[PC{l_3}\]
उत्तर: $PC{l_3}\;\;\;\;\;\;\;\;\;\;\;\;x + \left( { - 1} \right) \times 3 = 0$; या $\;x = + 3$
(iii) \[C{a_3}{P_2}\]
उत्तर: $\;C{a_3}{P_2}\;\;\;\;\;\;\;\left( { + 2} \right) \times 3 + \left( x \right) \times 2 = 0;$ या $\;x = - 3$
(iv) \[N{a_3}P{O_4}\]
उत्तर:$\;N{a_3}P{O_4}\;\;\;\;\;\;\left( { + 1} \right) \times 3 + x + \left( { - 2} \right) \times 4 = 0$; या $x = + 5$
(v) \[PO{F_3}\]
उत्तर:$PO{F_3}$ $x + \left( { - 2} \right) + \left( { - 1} \right) \times 3 = 0;$ या $x = + 5$
32. निम्नलिखित के लिए सन्तुलित समीकरण दीजिए –
(i) जब \[NaCl\] को \[Mn{O_2}\] की उपस्थिति में सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है।
उत्तर: $\left( i \right)\;\;NaCl\left( s \right) + {H_2}S{O_4}\left( {aq} \right) \to NaHS{O_4}\left( {aq} \right) + HCl\left( {aq} \right) \times 4$
$Mn{O_2}\left( s \right) + 4HCl\left( {aq} \right) \to MnC{l_2}\left( {aq} \right) + C{l_2}\left( g \right) + 2{H_2}O\left( l \right)$
—————————————————————————————————
$4NaCl\left( s \right) + Mn{O_2}\left( s \right) + 4{H_2}S{O_4}\left( {aq} \right) \to 4NaHS{O_4}\left( {aq} \right) - MnC{l_2}\left( {aq} \right) + C{l_2}\left( g \right) + 2{H_2}O\left( l \right)$
(ii) जब क्लोरीन गैस को \[NaI\] के जलीय विलयन में से प्रवाहित किया जाता है।
(ii) \[C{l_2}\left( g \right){\text{ }} + {\text{ }}2NaI{\text{ }}\left( {aq} \right){\text{ }} \to {\text{ }}2NaCl{\text{ }}\left( {aq} \right){\text{ }} + {\text{ }}{I_2}\left( s \right)\]
33: जीनॉन फ्लुओराइड \[Xe{F_2},{\text{ }}Xe{F_4}\] तथा \[Xe{F_6}\] कैसे बनाए जाते हैं?
उत्तर: जीनॉन फ्लुओराइडों को \[Xe\] तथा \[{F_2}\] के मध्य विभिन्न परिस्थितियों में सीधे अभिक्रिया द्वारा प्राप्त किया जाता है। \[Xe{\text{ }}\left( g \right){\text{ }} + {\text{ }}{F_2}{\text{ }}\left( g \right){\text{ }}\xrightarrow{{\left\{ {{\text{ }}673K,1bar{\text{ }}} \right\}}}{\text{ }}Xe{F_2}{\text{ }}\left( s \right){\text{ }}Xe{\text{ }}\left( g \right){\text{ }} + {\text{ }}2{F_2}{\text{ }}\left( g \right){\text{ }}\xrightarrow{{\left\{ {{\text{ }}873K,7bar{\text{ }}} \right\}}}{\text{ }}Xe{F_{4{\text{ }}}}\left( s \right){\text{ }}Xe{\text{ }}\left( g \right){\text{ }} + {\text{ }}3{F_2}{\text{ }}\left( g \right){\text{ }}\xrightarrow{{\left\{ {{\text{ }}573K,60 - 70bar{\text{ }}} \right\}}}{\text{ }}Xe{F_6}{\text{ }}\left( s \right)\]
34: किस उदासीन अणु के साथ \[Cl{O^ - }\] समइलेक्ट्रॉनी है? क्या यह अणु एक लूइस क्षारक है?
उत्तर: \[Cl{O^ - }\] में कुल $17 + 8 + 1 = 26$ इलेक्ट्रॉन हैं। यह $_.^.\mathop {\mathop {Cl}\limits_{..} }\limits^{..} - F$ अणु से समइलेक्ट्रॉनिक है क्योंकि ClF में भी $17 + 9 = 26$ इलेक्ट्रॉन उपस्थित हैं। $_.^.\mathop {\mathop {Cl}\limits_{..} }\limits^{..} - F$ एक लूइस बेस की भाँति व्यवहार करता है क्योंकि $_.^.\mathop {\mathop {Cl}\limits_{..} }\limits^{..} - F$ में क्लोरीन परमाणु पर इलेक्ट्रॉनों के तीन एकल युग्म (lone pairs) उपस्थित हैं। यह पुनः F से क्रिया कर ClF3 बना सकती है।
35: \[Xe{O_3}\] तथा \[Xe{F_4}\] किस प्रकार बनाए जाते हैं?
उत्तर: \[Xe{F_4}\] तथा \[Xe{F_6}\] के जल-अपघटन पर \[Xe{O_3}\] बनता है।
\[\begin{array}{*{20}{l}}
{6Xe{F_4} + {\text{ }}12{H_2}O{\text{ }} \to {\text{ }}4Xe{\text{ }} + {\text{ }}2Xe{O_3} + {\text{ }}24HF{\text{ }} + {\text{ }}3{O_2} \uparrow } \\
{Xe{F_6} + {\text{ }}3{H_2}O{\text{ }} \to {\text{ }}Xe{O_3} + {\text{ }}6HF}
\end{array}\]
जीनॉन तथा फ्लु ओरीन को \[1:5\] अनुपात में लेकर \[873{\text{ }}K\] तथा \[7{\text{ }}bar\] पर अभिक्रिया कराने पर \[Xe{F_4}\] बनता है।
$Xe\left( g \right) + 2\;{F_2}\left( g \right)\xrightarrow{{^{873\;K,7bar}}}Xe{F_4}\left( s \right)$
$(1:5$ अनुपात)
36: निम्नलिखित प्रत्येक समुच्चय को सामने लिखे गुणों के अनुसार सही क्रम में व्यवस्थित कीजिए – \[{F_2},{\text{ }}C{l_2},{\text{ }}B{r_2},{\text{ }}{I_2}\] – आबन्ध वियोजन एन्थैल्पी बढ़ते क्रम में। \[HF,{\text{ }}HCl,{\text{ }}HBr,{\text{ }}HI\] – अम्ल सामर्थ्य बढ़ते क्रम में। \[N{H_3},{\text{ }}P{H_3},{\text{ }}As{H_3},{\text{ }}Bi{H_3}\]– क्षारक सामर्थ्य बढ़ते क्रम में।
उत्तर: 1. \[{F_2}\] से \[{I_2}\] तक आबन्ध दूरी बढ़ने पर आबन्ध वियोजन एन्थैल्पी घटती है क्योंकि \[F\] से \[I\] की ओर जाने पर परमाणु के आकार में वृद्धि होती है। यद्यपि \[F - F\] आबन्ध वियोजन एन्थैल्पी, \[Cl{\text{ }}--{\text{ }}Cl\] की तुलना में कम होती है तथा \[Br{\text{ }}--{\text{ }}Br\] की आबन्ध वियोजन एन्थैल्पी से भी कम होती है। इसका कारण यह है कि \[F\] परमाणु अत्यधिक छोटा होता है तथा प्रत्येक \[F\] परमाणु पर इलेक्ट्रॉनों के तीन एकाकी युग्म \[{F_2}\] अणु में \[F - \] परमाणुओं को बाँधे रखने वाले आबन्ध युग्मों को प्रतिकर्षित करते हैं। अत: आबन्ध वियोजन एन्थैल्पी का बढ़ता क्रम इस प्रकार होता है- \[{I_2} < {\text{ }}{F_2} < {\text{ }}B{r_2} < {\text{ }}C{l_2}\].
2. \[HF,{\text{ }}HCl,{\text{ }}HBr,{\text{ }}HI\] की आपेक्षिक अम्ल सामर्थ्य इनकी आबन्ध वियोजन एन्थैल्पी पर निर्भर करती है। \[F\] से \[I\] तक परमाणु का आकार बढ़ने पर \[H - X\] आबन्ध की आबन्ध वियोजन एन्थैल्पी \[H{\text{ }}--{\text{ }}F\] से \[H{\text{ }}--{\text{ }}I\] तक घटती है। इसलिए अम्ल सामर्थ्य विपरीत क्रम में इस प्रकार बढ़ता है – \[HF{\text{ }} < {\text{ }}HCl{\text{ }} < {\text{ }}HBr{\text{ }} < {\text{ }}HI\].
3. \[N{H_3},{\text{ }}P{H_3},{\text{ }}As{H_3},{\text{ }}Bi{H_3}\] में केन्द्रीय परमाणु पर इलेक्ट्रॉनों के एकाकी युग्म की उपस्थिति के कारण ये सभी लुईस क्षारों की भाँति व्यवहार करते हैं। यद्यपि \[N{H_3}\] से \[Bi{H_3}\] तक जाने पर परमाणु का आकार बढ़ता है, परिणामस्वरूप इलेक्ट्रॉनों का एकाकी युग्म अधिक आयतन घेर लेता है। दूसरे शब्दों में, केन्द्रीय परमाणु पर इलेक्ट्रॉन घनत्व घटता है तथा क्षारक सामर्थ्य \[N{H_3}\] से \[Bi{H_3}\] तेक घटती है, इसलिए क्षारक सामर्थ्य का बढ़ता क्रम है- \[Bi{H_3} < {\text{ }}Sb{H_3} < {\text{ }}As{H_3} < {\text{ }}P{H_3} < {\text{ }}N{H_3}\].
37: निम्नलिखित में से कौन-सा एक अस्तित्व में नहीं है?
1. \[XeO{F_4}\]
2. \[Ne{F_2}\]
3. \[Xe{F_2}\]
4. \[Xe{F_6}\]
उत्तर: \[Ne{F_2}\] अस्तित्व में नहीं है। इसका कारण यह है कि फ्लोरीन \[Ne\] को \[N{e^{ + 2}}\] में ऑक्सीकृत नहीं कर सकता क्योंकि \[Ne\] की प्रथम तथा द्वितीय आयनन एन्थैल्पी के योग का मान \[Xe\] की तुलना में काफी अधिक है। इसलिए \[Xe{F_2}\], \[XeO{F_4}\], तथा \[Xe{F_6}\] प्राप्त किये जा सकते हैं, लेकिन \[Ne{F_2}\] नहीं।
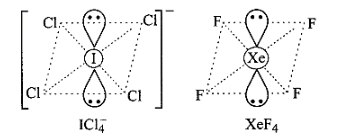
38: उस उत्कृष्ट गैस स्पीशीज का सूत्र देकर संरचना की व्याख्या कीजिए जो कि इनके साथ समसंरचनीय है – \[ICl_4^ - {\text{ }}IBr_2^ - {\text{ }}BrO_3^ - \]
उत्तर: 1. \[ICl_4^ - ,{\text{ }}Xe{F_4}\] से समइलेक्ट्रॉनिक है। दोनों वर्ग समतलीय हैं।
2. \[IBr_2^ - ,{\text{ }}Xe{F_2}\] से समइलेक्ट्रॉनिक है। दोनों रेखीय हैं।
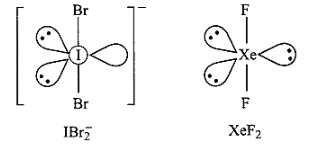
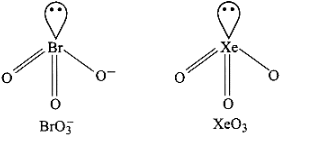
3. \[BrO_3^ - ,{\text{ }}Xe{O_3}\] से समइलेक्ट्रॉनिक है। दोनों पिरामिडीय आकृति के होते हैं।
39: उत्कृष्ट गैसों के परमाण्विक आकार तुलनात्मक रूप से बड़े क्यों होते हैं?
उत्तर: उत्कृष्ट गैसों की परमाण्विक त्रिज्या अपने सम्बन्धित आवर्गों में सर्वाधिक होती है। इसका कारण यह है कि उत्कृष्ट गैसों की त्रिज्या केवल वाण्डर वाल्स त्रिज्या होती है (क्योंकि ये अणु नहीं बनाती हैं), जबकि अन्यों की सहसंयोजक त्रिज्याएँ होती है। वाण्डर वाल्स त्रिज्या सहसंयोजक त्रिज्या से अधिक होती है, अतः उत्कृष्ट गैसों के परमाण्विक आकार तुलनात्मक रूप से बड़े होते हैं।
NCERT Solutions for Class 12 Chemistry Chapter 7 The p-Block Elements In Hindi Medium
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 12 Chemistry Chapter 7 solution Hindi mediums are created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 12 Chemistry Chapter 7 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 12 Chemistry Chapter 7 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 12 Chemistry The p-Block Elements solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 12 Chemistry The p-Block Elements in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 12 can download these solutions at any time as per their convenience for self-study purposes.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/ solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 12 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 12 Chemistry in Hindi Chapter 7 The P-Block Elements In Hindi Mediem (2025-26)
1. Where can I find accurate and detailed NCERT Solutions for Class 12 Chemistry Chapter 7, The p-Block Elements?
You can find comprehensive and step-by-step NCERT Solutions for Class 12 Chemistry Chapter 7, The p-Block Elements, on Vedantu. These solutions are crafted by subject matter experts to align with the CBSE curriculum, covering all in-text questions and end-of-chapter exercises to ensure a thorough understanding of the concepts.
2. Is 'The p-Block Elements' still part of the CBSE Class 12 Chemistry syllabus for the 2025-26 session?
No, as per the latest rationalised syllabus for 2025-26, the chapter 'The p-Block Elements' has been removed from the CBSE Class 12 Chemistry curriculum. While these NCERT solutions are valuable for students using older textbooks or preparing for other competitive exams that may still include this topic, it is not a part of the current board examination syllabus.
3. How do the NCERT Solutions explain the anomalous behaviour of nitrogen in Group 15?
The NCERT Solutions explain the anomalous behaviour of nitrogen by breaking down the reasons into clear points. The solutions highlight its:
- Small atomic size: Leading to high ionisation enthalpy and electronegativity.
- Absence of d-orbitals: This restricts its covalency to a maximum of 4 and prevents it from forming pπ-dπ multiple bonds.
- Unique ability to form pπ-pπ multiple bonds: This is why nitrogen exists as a diatomic molecule (N₂) with a strong triple bond, making it inert.
4. What is the correct method to solve questions on the structures of Xenon compounds (Group 18) as per NCERT guidelines?
The correct method, as detailed in the NCERT solutions, involves using the VSEPR (Valence Shell Electron Pair Repulsion) theory. The steps are:
1. Determine the number of valence electrons of the central atom (Xenon).
2. Count the number of bond pairs and lone pairs around the central atom.
3. Identify the geometry based on the total electron pairs and predict the final structure by considering the repulsions (lp-lp > lp-bp > bp-bp). For example, in XeF₄, there are 4 bond pairs and 2 lone pairs, leading to a square planar structure.
5. How do the NCERT Solutions help in solving problems related to the oxidizing power of halogens (Group 17)?
The solutions clarify that the oxidizing power of halogens decreases down the group (F₂ > Cl₂ > Br₂ > I₂). They explain this trend based on standard electrode potentials (E°). A higher positive E° value indicates a stronger oxidizing agent. The solutions provide solved examples where a halogen can oxidise halide ions of higher atomic number, for instance, F₂ can oxidise Cl⁻, Br⁻, and I⁻ ions.
6. Why is the inert pair effect a crucial concept for solving questions on Group 13-16 elements in this chapter?
The inert pair effect is crucial because it explains the increasing stability of the lower oxidation state for heavier elements in these groups. The NCERT solutions demonstrate how the reluctance of the two s-electrons in the valence shell to participate in bonding affects chemical properties. For instance, the solutions show why Pb²⁺ is more stable than Pb⁴⁺, and Bi³⁺ is more stable than Bi⁵⁺. Understanding this concept is key to correctly predicting the outcomes of many reactions in the exercises.
7. Do the provided NCERT Solutions for 'The p-Block Elements' cover both in-text and end-of-chapter exercises?
Yes, the NCERT Solutions available on Vedantu for this chapter are comprehensive. They provide detailed, step-by-step answers for all the in-text questions (the questions embedded within the chapter's text) as well as the complete set of end-of-chapter exercises, ensuring no part of the textbook is left unsolved.
8. How can I use the NCERT solutions to understand the preparation and properties of compounds like Ammonia (Haber process) and Sulphuric Acid (Contact process)?
The NCERT solutions guide you through the principles and chemical equations for these industrial processes. For the Haber process, they explain the conditions of high pressure and temperature and the role of the catalyst, as per Le Chatelier's principle. For the Contact process, the solutions detail each step, from the oxidation of SO₂ to SO₃ to its absorption in H₂SO₄, helping you master the reaction mechanisms required to answer board-level questions effectively.
























