
Step-by-Step Solutions For Class 12 Chemistry Chapter 8 In Hindi - Free PDF Download
Download the Class 12 Chemistry NCERT Solutions in Hindi medium and English medium as well offered by the leading e-learning platform Vedantu. If you are a student of Class 12, you have reached the right platform. The NCERT Solutions for Class 12 Chemistry in Hindi provided by us are designed in a simple, straightforward language, which are easy to memorise. You will also be able to download the PDF file for NCERT Solutions for Class 12 Chemistry in Hindi from our website at absolutely free of cost.
NCERT, which stands for The National Council of Educational Research and Training, is responsible for designing and publishing textbooks for all the classes and subjects. NCERT textbooks covered all the topics and are applicable to the Central Board of Secondary Education (CBSE) and various state boards.
Class: | |
Subject: | |
Chapter Name: | Chapter 8 - The d and f Block Elements |
Content-Type: | Text, Videos, Images and PDF Format |
Academic Year: | 2025-26 |
Medium: | English and Hindi |
Available Materials: |
|
Other Materials |
|
We, at Vedantu, offer free NCERT Solutions in English medium and Hindi medium for all the classes as well. Created by subject matter experts, these NCERT Solutions in Hindi are very helpful to the students of all classes.
Access NCERT Solutions for Chemistry Chapter 8 – d-एवं f-ब्लॉक के तत्त्व
1. निम्नलिखित के इलेक्ट्रॉनिक विन्यास लिखिए –
$\mathbf{{C{r^{3 + }}}}$
${\mathbf{\;P{m^{3 + }}}}$
$\mathbf{{Cu + }}$
$\mathbf{{C{e^{4 + }}}}$
$\mathbf{{C{o^{2 + }}}}$
$\mathbf{{L{u^{2 + }}}}$
$\mathbf{{M{n^{2 + }}}}$
$\mathbf{{T{h^{4 + }}}}$
उत्तर:
${C{r^{3 + }}:\left[ {Ar} \right]{\text{ }}3{d^3}}$
${\;P{m^{3 + }}:{\text{ }}\left[ {Xe} \right]{\text{ }}4{f^4}}$
${Cu + :{\text{ }}\left[ {Ar} \right]{\text{ }}3{d^{10}}}$
${C{e^{4 + }}:{\text{ }}\left[ {Xe} \right]{\text{ }}4{f^0}}$
${C{o^{2 + }}:{\text{ }}\left[ {Ar} \right]{\text{ }}3{d^7}}$
${L{u^{2 + }}:{\text{ }}\left[ {Xe} \right]{\text{ }}4{f^{14}}{\text{ }}5{d^1}}$
${M{n^{2 + }}:{\text{ }}\left[ {Ar} \right]{\text{ }}3{d^5}}$
${T{h^{4 + }}:{\text{ }}\left[ {Rn} \right]{\text{ }}5{f^0}}$
2. \[\mathbf{ + 3}\] ऑक्सीकरण अवस्था में ऑक्सीकृत होने के सन्दर्भ में \[\mathbf{M{n^{2 + }}}\] के यौगिक \[\mathbf{F{e^{2 + }}}\] के यौगिकों की तुलना में अधिक स्थायी क्यों हैं?
उत्तर: \[M{n^{2 + }}\] का इलेक्ट्रॉनिक विन्यास \[\left[ {Ar} \right]{\text{ }}3{d^5}\] है, जबकि \[F{e^{2 + }}\] का \[\left[ {Ar} \right]{\text{ }}3{d^6}\] है। चूंकि \[M{n^{2 + }}\] में अर्द्ध-पूर्ण कक्ष $3{d^5}$ होती है, जो कि \[F{e^{2 + }}\] की $3{d^6}$ कक्ष से अधिक स्थायी है, इसलिए \[M{n^{2 + }}\] यौगिक सरलता से \[M{n^{3 + }}\] में ऑक्सीकृत नहीं होते हैं क्योंकि इनकी द्वितीय आयनन एन्थैल्पी बहुत अधिक होती है। इसके विपरीत, \[F{e^{2 + }}\] यौगिक कम द्वितीय आयनन एन्थैल्पी के कारण \[F{e^{3 + }}\] में सरलता से ऑक्सीकृत हो जाता है। यही कारण है कि \[M{n^{2 + }}\] यौगिक अपनी $ + 3$ अवस्था के लिए ऑक्सीकरण के प्रति \[F{e^{2 + }}\] से अधिक स्थायी होते हैं।
3. संक्षेप में स्पष्ट कीजिए कि प्रथम संक्रमण श्रेणी के प्रथम अर्द्धभाग में बढ़ते हुए परमाणु क्रमांक के साथ $ \mathbf{+ 2}$ ऑक्सीकरण अवस्था कैसे अधिक स्थायी होती जाती है?
उत्तर: प्रथम संक्रमण श्रेणी में बायें से दाये जाने पर \[I{E_1}{\text{ }} + {\text{ }}I{E_2}\] का योग बढ़ता जाता है। इसके परिणामस्वरूप \[{M^{2 + }}\] आयन बनाने की प्रवृत्ति घटती जाती है। यही कारण है कि श्रेणी के प्रथम अर्द्ध भाग में $ + 2$ अवस्था अधिकाधिक स्थायी होती है।
4. प्रथम संक्रमण श्रेणी के तत्वों के इलेक्ट्रॉनिक विन्यास किस सीमा तक ऑक्सीकरण अवस्थाओं को निर्धारित करते हैं?
उत्तर: को उदाहरण देते हुए स्पष्ट कीजिए। उत्तर जिस ऑक्सीकरण अवस्था में आयनों में पूर्ण भरी या अर्द्ध भरी $d$ कक्ष होती है, वे आयन अधिक स्थायी होते हैं। जैसे $Mn$ की $ + 2$ अवस्था इसकी अन्य ऑक्सीकरण अवस्थाओं की अपेक्षा अधिक स्थायी होती है। जैसे $Mn$ की $ + 2$ अवस्था इसकी अन्य ऑक्सीकरण अवस्थाओं की अपेक्षा अधिक स्थायी होती है। क्योंकि \[M{n^{2 + }}\] में अर्द्ध भरी $3{d^5}$ कक्ष होती है। इसी प्रकार $Zn$ की $ + 2$ अवस्था इसकी सबसे अधिक स्थायी अवस्था होती है क्योंकि इसमें पूर्ण भरी $3{d^{10}}$ कक्ष होती है।
5. संक्रमण तत्वों की मूल अवस्था में नीचे दिए गए $d$ इलेक्ट्रॉनिक विन्यासों में कौन-सी ऑक्सीकरण अवस्था स्थायी होगी? \[\mathbf{3{d^3},{\text{ }}3{d^5},{\text{ }}3{d^8},3{d^4}}\]
उत्तर: \[3{d^3}\] (वैनेडियम) : \[ + 2,{\text{ }} + 3,{\text{ }} + 4,{\text{ }} + 5\]
\[3{d^5}\] (क्रोमियम) : \[ + 3,{\text{ }} + 4,{\text{ }} + 6\]
\[3{d^5}\] (मैंग्नीज) : \[ + 2,{\text{ }} + 4,{\text{ }} + 6,{\text{ }} + 7\]
\[3{d^8}\] (कोबाल्ट) : \[ + 2,{\text{ }} + 3\]
\[3{d^4}\]: इस विन्यास वाला कोई भी तत्त्व तलस्थ अवस्था में नहीं पाया जाता है।
6. प्रथम संक्रमण श्रेणी के ऑक्सो-धातुऋणायनों का नाम लिखिए, जिसमें धातु संक्रमण श्रेणी की वर्ग संख्या के बराबर ऑक्सीकरण अवस्था प्रदर्शित करती है।
उत्तर: \[C{r_2}{O_2}^{ - 7}\] तथा \[Cr{O_2}^{4 - }\] में क्रोमियम \[ + 6\] अवस्था प्रदर्शित करता है, जो कि इसके समूह की संख्या (6) के बराबर है। \[Mn{O^{4 - }}\] में \[M{n^{ + 7}}\] अवस्था प्रदर्शित करता है, जो कि इसकी समूह की संख्या \[\left( 7 \right)\] के बराबर है। VO–3 में V+ 5 अवस्था प्रदर्शित करता है, जो कि इसकी समूह की संख्या \[\left( 5 \right)\] के बराबर है।
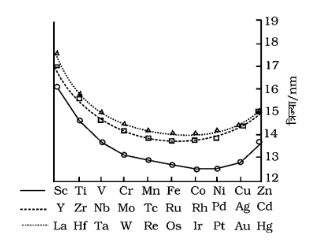
7. लैन्थेनाइड आकुंचन क्या है? लैन्थेनाइड आकुंचन के परिणाम क्या हैं?
उत्तर: लैन्थेनाइड आकुंचन (Lanthanoid Contraction) – लैन्थेनाइड श्रेणी में परमाणु क्रमांक बढ़ने पर परमाण्विक तथा आयनिक त्रिज्याएँ एक तत्व से दूसरे तत्व तक घटती हैं, परन्तु यह कमी अत्यन्त कम होती है। उदाहरणार्थ–\[Ce\] से \[Lu\] तक जाने पर परमाण्विक त्रिज्या \[183{\text{ pm}}\] से \[173{\text{ pm}}\] तक घट जाती है तथा यह कमी केवल \[10{\text{ pm}}\] है। इसी प्रकार \[C{e^{3 + }}\] से \[L{u^{3 + }}\] आयन तक जाने पर आयनिक त्रिज्या \[103{\text{ pm}}\] से घटकर \[85{\text{ pm}}\] रह जाती है तथा यह कमी केवल \[18{\text{ pm}}\] है। अत: परमाणु क्रमांक में \[14\] की वृद्धि के लिए, परमाण्विक तथा आयनिक त्रिज्याओं में होने वाली कमी अत्यन्त कम है। यह कमी अन्य वर्गों तथा आवर्तो के तत्वों की तुलना में अत्यल्प है। सारणी-लैन्थेनम तथा लैन्थेनाइडों के परमाण्विक तथा आयनिक त्रिज्याओं में परिवर्तन (pm)
तत्व | \[La\] | Ce | \[Pr\] | \[Nd\] | \[Pm\] | \[Sm\] | \[Eu\] | \[Gd\] | \[Tb\] | \[Dy\] | \[Ho\] | \[Er\] | \[Tm\] | \[Yb\] | \[Lu\] |
त्रिज्या \[\left( {Ln} \right)\] | 187 | 183 | 182 | 181 | 181 | 180 | 199 | 180 | 178 | 177 | 176 | 175 | 174 | 173 | __ |
त्रिज्या \[\left( {L{n^{3 + }}} \right)\] | 106 | 175 | 101 | 99 | 98 | 96 | 95 | 94 | 92 | 91 | 89 | 88 | 87 | 85 | __ |
लैन्थेनाइड तत्वों में परमाणु क्रमांक बढ़ने पर उनके परमाणु तथा आयनिक आकारों में होने वाली स्थिर कमी ‘लैन्थेनाइड आकुंचन’ कहलाती है। त्रिसंयोजी लैन्थेनॉइडों \[\left( {L{n^{3 + }}} \right)\] की आयनिक त्रिज्याओं में कमी चित्र में दर्शायी गई है।
लैन्थेनाइड आकुंचन का कारण
(Cause of Lanthanide Contraction) – लेन्थेनाइड श्रेणी में एक तत्व से दूसरे तत्व तक जाने पर नाभिकीय आवेश एक इकाई बढ़ता है तथा एक इलेक्ट्रॉन जुड़ता है। ये नए इलेक्ट्रॉन समानान्तर 4f- उपकोशों में जुड़ते हैं। यद्यपि एक \[4f - \] इलेक्ट्रॉन का दूसरे \[4f - \] इलेक्ट्रॉन पर परिरक्षण प्रभाव (नाभिकीय आवेश से), \[f - \]कक्षकों के अत्यन्त विस्तृत आकार के कारण, कम होता है। यद्यपि नाभिकीय आवेश प्रत्येक पद पर एक इकाई बढ़ जाता है, इसलिए परमाणु क्रमांक तथा नाभिकीय आवेश बढ़ने पर प्रत्येक \[4f - \] इलेक्ट्रॉन द्वारा अनुभव किया जाने वाला प्रभावी नाभिकीय आवेश बढ़ जाता है, परिणामस्वरूप सम्पूर्ण \[4f - \] इलेक्ट्रॉन कोश प्रत्येक तत्व के जुड़ने पर आकुंचित हो जाता है, यद्यपि यह कमी अत्यन्त अल्प होती है। इसके परिणामस्वरूप परमाणु क्रमांक बढ़ने पर लैन्थेनाइडों के आकार में नियमित हस पाया जाता है। क्रमिक अपचयनों का योग कुल लैन्थेनाइड आकुंचन देता है। लैन्थेनाइड आकुंचन के परिणाम (Consequences of Lanthanide Contraction) – लैन्थेनाइड आकुंचन के महत्त्वपूर्ण परिणाम निम्नलिखित हैं – (1) द्वितीय तथा तृतीय संक्रमण श्रेणियों की समानता (Resemblance of second and third transition series) – आवर्त सारणी में लैन्थेनाइडों से पहले तथा बाद में आने वाले तत्वों के आपेक्षिक गुणों पर इसका महत्त्वपूर्ण प्रभाव पड़ता है।
लैन्थेनाइड आकुंचन इसी प्रकार हम अन्य वर्गों में आकार में सामान्य वृद्धि की अपेक्षा कर सकते हैं, यद्यपि लैन्थेनाइडों के पश्चात् द्वितीय से तृतीय संक्रमण श्रेणियों में त्रिज्याओं की वृद्धि लगभग नगण्य होती है। \[Ti{\text{ }} \to {\text{ }}Zr{\text{ }} \to {\text{ }}Hf{\text{ }}V{\text{ }} \to {\text{ }}Nb{\text{ }} \to {\text{ }}Ta\] आदि तत्वों के युग्मों; जैसे- \[Zr{\text{ }}--{\text{ }}Hf,{\text{ }}Nb{\text{ }}--{\text{ }}Ta,{\text{ }}Mo{\text{ }}--{\text{ }}W\] आदि के आकार समान (लगभग) होते हैं तथा इन तत्वों के गुण भी समान होते हैं। अत: लैन्थेनाइड आकुंचन के परिणामस्वरूप द्वितीय तथा तृतीय संक्रमण श्रेणियों के तत्व, प्रथम तथा द्वितीय संक्रमण श्रेणियों के तत्वों की तुलना में परस्पर अत्यधिक समानता रखते हैं।
(2) लैन्थेनाइडों में समानता (Similarity among lanthanides) – लैन्थेनाइडों की त्रिज्याओं में अत्यन्त अल्प-परिवर्तन के कारण, इनके रासायनिक गुण लगभग समान होते हैं। अतः तत्वों को शुद्ध अवस्था में पृथक्कृत करना अत्यन्त कठिन होता है। पुनरावृत्त प्रभाजी क्रिस्टलन अथवा आयन-विनिमय तकनीकों पर आधारित आधुनिक विधियों द्वारा इनके त्रिसंयोजी आयनों के आकारों में अत्यल्प-अन्तर के आधार पर इन्हें पृथक्कृत किया जाता है। इन विधियों द्वारा तत्वों के गुणों जैसे विलेयता, संकुल आयन निर्माण, जलयोजन आदि में बहुत कम अन्तर के आधार पर इन्हें पृथक्कृत किया जाता है।
(3) क्षारकता अन्तर (Basicity differences) – लैन्थेनाइड आकुंचन के कारण लैन्थेनाइड आयनों का आकार, परमाणु क्रमांक बढ़ने के साथ नियमित रूप से घटता है। आकार में कमी के फलस्वरूप लैन्थेनाइड आयन तथा OH आयनों के मध्य इनके सहसंयोजक गुण \[L{a^{3 + }}\] से \[L{u^{3 + }}\] तक बढ़ते हैं, इसलिए परमाणु क्रमांक बढ़ने पर हाइड्रॉक्साइडों की क्षारकीय सामर्थ्य घटती है। अत: \[La{\left( {OH} \right)_3}\] अधिकतम क्षारकीय है, जबकि \[Lu{\left( {OH} \right)_3}\] सबसे कम क्षारकीय है।
8. संक्रमण धातुओं के अभिलक्षण क्या हैं? ये संक्रमण धातु क्यों कहलाती हैं? \[d - \]ब्लॉक के तत्वों में कौन-से तत्व संक्रमण श्रेणी के तत्व नहीं कहे जा सकते?
उत्तर: संक्रमण धातुओं के सामान्य अभिलक्षण (General Characteristics of Transition Elements) – संक्रमण धातुओं (\[d - \] ब्लॉक के तत्वों) के सामान्य अभिलक्षण निम्नलिखित हैं – लगभग सभी संक्रमण तत्व अभिधात्विक गुण जैसे उच्च तनन सामर्थ्य (tensile strength), तन्यता (ductility), वर्धनीयता (malleability), उच्च तापीय तथा विद्युत चालकता तथा धात्विक चमक दर्शाते हैं। मर्करी को छोड़कर, जो कमरे के ताप पर द्रव है, अन्य संक्रमण तत्वों की अभिधात्विक संरचनाएँ होती हैं। इनके गलनांक तथा क्वथनांक उच्च होते हैं तथा असंक्रमण तत्वों की तुलना में इनकी वाष्पन ऊष्मा उच्च होती है। \[s - \] ब्लॉक तत्वों की तुलना में संक्रमण तत्वों के घनत्व उच्च होते हैं। \[d - \] ब्लॉक के तत्वों की प्रथम आयनन ऊर्जाएँ \[s - \] ब्लॉक के तत्वों से अधिक, परन्तु \[p - \] ब्लॉक के तत्वों से कम होती हैं। इनकी प्रवृत्ति विद्युत धनात्मक होती है। इनमें से अधिकांश तत्व रंगीन यौगिक बनाते हैं। इनमें संकुल बनाने की प्रवृत्ति अत्यधिक होती है। ये अनेक ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। इनके यौगिक सामान्यतया अनुचुम्बकीय प्रवृत्ति के होते हैं। ये अन्य धातुओं के साथ मिश्रधातु (alloy) बनाते हैं।
ये कुछ तत्वों; जैसे हाइड्रोजन, बोरॉन, कार्बन, नाइट्रोजन आदि के साथ अन्तराकाशी यौगिक बनाते हैं। अधिकांश संक्रमण धातुएँ जैसे \[Mn,{\text{ }}Ni,{\text{ }}Co,{\text{ }}Cr,{\text{ }}V,{\text{ }}Pt\] आदि तथा इनके यौगिक उत्प्रेरकों के रूप में प्रयुक्त किए जाते हैं। \[d - \] ब्लॉक के तत्व संक्रमण धातुएँ कहलाते हैं क्योंकि ये तत्व अधिक विद्युत-धनात्मक \[s - \]ब्लॉक के तत्वों तथा कम विद्युत-धनात्मक \[s - \] ब्लॉक के तत्वों से मध्यवर्ती गुण प्रदर्शित करते हैं तथा आवर्त सारणी में इनका स्थान \[s - \] तथा \[p - \] ब्लॉक के तत्वों के मध्य में है।
\[Zn,{\text{ }}Cd\] तथा \[Hg\] का इलेक्ट्रॉनिक विन्यास सामान्य सूत्र \[\left( {n{\text{ }}--{\text{ }}1} \right){d^{10}}n{s^2}\] से प्रदर्शित किया जाता है। इन तत्वों में कक्षक तलस्थ (सामान्य) अवस्था में तथा साधारण ऑक्सीकरण अवस्थाओं में भी पूर्णपूरित होते हैं अर्थात् इनकी परमाण्विक अवस्था अथवा किसी भी एक आयनिक अवस्था में उपकोश अपूर्ण नहीं होते हैं, इसलिए इन्हें संक्रमण तत्व नहीं कहा जा सकता।
9. संक्रमण धातुओं के इलेक्ट्रॉनिक विन्यास किस प्रकार असंक्रमण तत्वों के इलेक्ट्रॉनिक विन्यास से भिन्न हैं?
उत्तर: संक्रमण तत्त्वों के इलेक्ट्रॉनिक विन्यास \[\left( {n{\text{ }}--{\text{ }}1} \right){d^{1{\text{ }}--{\text{ }}10}}n{s^{1{\text{ }}--{\text{ }}2}}\] प्रकार के होते हैं तथा इस प्रकार इनमें अपूर्ण \[d - \] ऑर्बिटल होती है जबकि असंक्रमण तत्त्वों में \[d - \] ऑर्बिटल नहीं पायी जाती है। इनके इलेक्ट्रॉनिक विन्यास \[n{s^{1{\text{ }}--{\text{ }}2}}\] या \[n{s^2}n{p^{1{\text{ }}--{\text{ }}6}}\] प्रकार के होते हैं।
10. लैन्थेनाइडों द्वारा कौन-कौन सी ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं? (2014)
उत्तर: लैन्थेनाइडों की ऑक्सीकरण अवस्थाएँ (Oxidation States of Lanthanides) – आवर्त सारणी के वर्ग 3 के सदस्यों से प्रत्याशित होता है कि लेन्थेनाइडों की एकसमान \[ + 3\] ऑक्सीकरण अवस्था उनकी एक विशेषता है। त्रिधनात्मक ऑक्सीकरण अवस्था \[6{s^2}\] इलेक्ट्रॉन और एकाकी \[5d - \] इलेक्ट्रॉन अथवा यदि कोई \[5d - \] इलेक्ट्रॉन उपस्थित न हो तो \[f - \] इलेक्ट्रॉनों में से एक के उपयोग के अनुसार होती है। प्रथम तीन आयनन एन्थैल्पियों का योग अपेक्षाकृत निम्न होता है जिससे ये तत्व उच्च धनविद्युती होते हैं और तत्परता से \[ + 3\] आयन बना लेते हैं। यद्यपि जलीय विलयन में तथा ठोस अवस्था में सीरियम \[\left( {C{e^{4 + }}} \right)\] चर्तुधनात्मक तथा सैमेरियम, यूरोपियम और इटर्बियम (\[S{m^{2 + }},{\text{ }}E{u^{2 + }}\] और \[Y{b^{2 + }}\]) द्विधनात्मक आयन दे सकते हैं। अन्य तत्व ठोस अवस्था में \[ + 4\] अवस्था दे सकते हैं। \[M{X_3}\] का अपचयन न केवल \[M{X_2}\] अपितु विशेष स्थिति में जटिल अपचयित स्पीशीज भी दे सकता है। लैन्थेनाइडों के लिए \[ + 3\] ऑक्सीकरण अवस्था की धारणा पर्याप्त दृढ़ हो गई है तथा अन्य ऑक्सीकरण अवस्थाओं को प्रायः असंगत’ कहा जाता है। विभिन्न लैन्थेनाइडों की ऐसी असंगत ऑक्सीकरण अवस्थाएँ अग्र प्रकार प्रदर्शित की गई हैं –
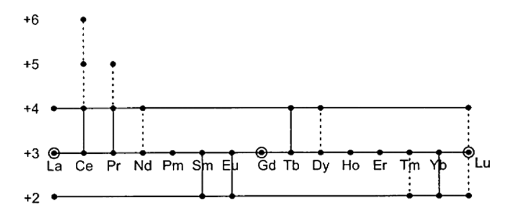
यदि हम यह मान लें कि रिक्त, अर्द्धपूर्ण या पूर्ण \[f - \] उपकोश के साथ विशेष स्थायित्व सम्बन्धित होता है। तो एक निश्चित सीमा तक \[ + 2\] तथा \[ + 4\] ऑक्सीकरण अवस्थाओं की उपस्थिति का इलेक्ट्रॉनिक संरचनाओं के साथ सामंजस्य किया जा सकता है। इस प्रकार \[La,{\text{ }}Gd\] और \[Lu\] केवल त्रिधनात्मक आयन निर्मित करते हैं क्योंकि तीन इलेक्ट्रॉनों के निष्कासन से \[L{a^{3 + }}\] आयन में उत्कृष्ट गैस का विन्यास बन जाता है।
\[G{d^{3 + }}\] तथा \[L{u^{3 + }}\] आयनों में क्रमशः स्थायी विन्यास \[4{f^7}\] तथा \[4{f^{14}}\] से इलेक्ट्रॉनों का निष्कासन नहीं होता क्योंकि \[{M^{3 + }}\] आयनों की अपेक्षा \[{M^{2 + }}\] अथवा \[{M^ + }\] आयनों की जालक अथवा जलयोजन ऊर्जाएँ लघु \[{M^{3 + }}\] आयनों के लवणों की योगात्मक जालक या जलयोजन ऊर्जाओं की अपेक्षा कम होगी। सबसे अधिक स्थायी द्वि या चतुर्धनात्मक आयन उन तत्वों द्वारा निर्मित होते हैं जो ऐसा करके \[{f^9},{\text{ }}{f^7}\] तथा \[{f^{14}}\] विन्यास प्राप्त कर सकते हों। इस प्रकार सीरियम \[ + 4\] ऑक्सीकरण अवस्था में आकर \[{f^0}\] विन्यास प्राप्त कर लेता है। यूरोपियम तथा इटर्बियम \[ + 2\] ऑक्सीकरण अवस्था में क्रमशः \[{f^7}\] तथा \[{f^{14}}\] विन्यास प्राप्त कर लेते हैं। ये तथ्य इस धारणा का समर्थन करते प्रतीत होते हैं कि लैन्थेनाइडों के लिए \[ + 3\] के अतिरिक्त दूसरी ऑक्सीकरण अवस्थाओं का अस्तित्व निर्धारित करने में \[{f^0},{\text{ }}{f^7}\] तथा \[{f^{14}}\] विन्यासों का विशेष स्थायित्व महत्त्वपूर्ण है, परन्तु यह तर्क कम निर्णयात्मक हो जाता है जब हम देखते हैं कि सैमेरियम और थूलियम \[{f^6}\] तथा \[{f^{13}}\] विन्यास रखते हुए \[{M^{2 + }}\] आयन बनाते हैं, \[{M^ + }\] आयन नहीं। साथ ही प्रेजियोडिमियम एवं नियोडिमियम \[{f^1}\] तथा \[{f^2}\] विन्यासों के साथ \[{M^{4 + }}\] आयन बनाते हैं, परन्तु कोई पंच या षट-संयोजक प्रकार के आयन नहीं बनाते। इसमें सन्देह नहीं है कि \[Sm\left( {II} \right)\] और विशेषकर \[Tm\left( {II} \right),{\text{ }}Pr\left( {IV} \right)\] तथा \[Nd\left( {IV} \right)\] अवस्थाएँ बहुत अस्थायी हैं, परन्तु यह विचार भी संदिग्ध है कि \[{f^0},{\text{ }}{f^7}\] या \[{f^{14}}\] विन्यास के केवल समीप पहुँच जाना भी स्थायित्व के लिए सहायक होता है चाहे ऐसा कोई विन्यास वस्तुतः प्राप्त नहीं भी हो। \[N{d^{2 + }}\left( {f4} \right)\] का अस्तित्व यह विश्वास करने के लिए विशेष निर्णयात्मक प्रमाण है कि यद्यपि \[{f^0},{\text{ }}{f^7},{\text{ }}{f^{14}}\] विन्यास का स्थायित्व ऑक्सीकरण अवस्थाओं का स्थायित्व निर्धारण करने में एक घटक हो सकता है, यद्यपि अन्य ऊष्मागतिकीय तथा गतिकीय घटक विशेष भी हैं जिनका समान या अधिक महत्त्व है।
11. कारण देते हुए स्पष्ट कीजिए – संक्रमण धातुएँ तथा उनके अधिकांश यौगिक अनुचुम्बकीय हैं। संक्रमण धातुओं की कणन एन्थैल्पी के मान उच्च होते हैं। संक्रमण धातुएँ सामान्यतः रंगीन यौगिक बनाती हैं। संक्रमण धातुएँ तथा इनके अनेक यौगिक उत्तम उत्प्रेरक का कार्य करते हैं।
उत्तर:
पदार्थों में अनुचुम्बकत्व की उत्पत्ति, अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण होती है। प्रतिचुम्बकीय पदार्थ वे होते हैं जिनमें सभी इलेक्ट्रॉन युग्मित होते हैं। संक्रमण धातु आयनों में प्रतिचुम्बकत्व तथा अनुचुम्बकत्व दोनों होते हैं अर्थात् इनमें दो विपरीत प्रभाव पाए जाते हैं, इसलिए परिकलित चुम्बकीय आघूर्ण इनका परिणामी चुम्बकीय आघूर्ण माना जाता है। \[{d^0}\left( {S{c^{3 + }},{\text{ }}T{i^{4 + }}} \right)\] या \[{d^{10}}\left( {C{u^ + },{\text{ }}Z{n^{2 + }}} \right)\] विन्यासों को छोड़कर, संक्रमण धातुओं के सभी सरल आयनों में इनके \[\left( {n{\text{ }}--{\text{ }}1} \right){\text{ }}d\] उपकोशों में अयुग्मित इलेक्ट्रॉन होते हैं; अत: ये अधिकांशत: अनुचुम्बकीय होते हैं। ऐसे अयुग्मित इलेक्ट्रॉन का चुम्बकीय आघूर्ण, प्रचक्रण कोणीय संवेग तथा कक्षीय कोणीय संवेग से सम्बन्धित होता है। प्रथम संक्रमण श्रेणी की धातुओं के यौगिकों में कक्षीय कोणीय संवेग को योगदान प्रभावी रूप से शमित (quench) हो जाता है, इसलिए इसका कोई महत्त्व नहीं रह जाता। अत: इनके लिए चुम्बकीय आघूर्ण का निर्धारण उसमें उपस्थित अयुग्मित इलेक्ट्रॉनों की संख्या के आधार पर किया जाता है तथा इसकी गणना निम्नलिखित ‘प्रचक्रण मात्र’ सूत्र द्वारा की जाती है- $\mu = \sqrt {n(n + 2)} $ यहाँ ${\text{'n'}}$ अयुग्मित इलेक्ट्रॉनों की संख्या है तथा ॥ चुम्बकीय आघूर्ण है जिसका मात्रक बोर मैग्नेटॉन (BM) है। अतः एक अयुग्मित इलेक्ट्रॉन का चुम्बकीय आघूर्ण \[1.73{\text{ BM}}\] होता है।
संक्रमण धातुओं की कणन एन्थैल्पी के मान उच्च होते हैं क्योंकि इनके परमाणुओं में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है। इस कारण इनमें प्रबल अन्तरापरमाण्विक अन्योन्य-क्रियाएँ होती हैं। तथा इसलिए परमाणुओं के मध्य प्रबल आबन्ध उपस्थित होते हैं।
अधिकांश संक्रमण धातु आयन विलयन तथा ठोस अवस्थाओं में रंगीन होते हैं। ऐसा दृश्य प्रकाश के आंशिक अवशोषण के कारण होता है। अवशोषित प्रकाश इलेक्ट्रॉन को समान \[d - \] उपकोश के एक कक्षक से दूसरे कक्षक में उत्तेजित कर देता है। चूंकि इलेक्ट्रॉनिक संक्रमण धातु आयनों के d-कक्षकों में होते हैं, इसलिए ये \[d - d\] संक्रमण कहलाते हैं। संक्रमण धातु आयनों में दृश्य प्रकाश को अवशोषित करके होने वाले \[d - d\] संक्रमणों के कारण ही ये रंगीन दिखाई देते हैं।
संक्रमण धातुएँ तथा इनके यौगिक उत्प्रेरकीय सक्रियता के लिए जाने जाते हैं। संक्रमण धातुओं का यह गुण उनकी परिवर्तनशील संयोजकता एवं संकुल यौगिक के बनाने के गुण के कारण है। वैनेडियम \[\left( V \right)\] ऑक्साइड (संस्पर्श प्रक्रम में), सूक्ष्म विभाजित आयरन (हेबर प्रक्रम में) और निकिल (उत्प्रेरकीय हाइड्रोजनीकरण में) संक्रमण धातुओं के द्वारा उत्प्रेरण के कुछ उदाहरण हैं। उत्प्रेरक के ठोस पृष्ठ पर अभिकारक के अणुओं तथा उत्प्रेरक की सतह के परमाणुओं के बीच आबन्धों की रचना होती है। आबन्ध बनाने के लिए प्रथम संक्रमण श्रेणी की धातुएँ \[3d\] एवं \[4s\] इलेक्ट्रॉनों का उपयोग करती हैं, परिणामस्वरूप उत्प्रेरक की सतह पर अभिकारक की सान्द्रता में वृद्धि हो जाती है तथा अभिकारक के अणुओं में उपस्थित आबन्ध दुर्बल हो जाते हैं। इन कारण सक्रियण ऊर्जा का मान घटे जाता है। ऑक्सीकरण अवस्थाओं में परिवर्तन हो सकने के कारण संक्रमण धातुएँ उत्प्रेरक के रूप में अधिक प्रभावी होती हैं। उदाहरणार्थ– आयरन (III), आयोडाइड आयन तथा परसल्फेट आयन के बीच सम्पन्न होने वाली अभिक्रिया को उत्प्रेरित करता है।
\[2{I^--} + {\text{ }}{S_2}{O_2}^{ - 8} \to {\text{ }}I2{\text{ }} \uparrow {\text{ }} + {\text{ }}2S{O_2}^{ - 4}\] इस उत्प्रेरकीय अभिक्रिया का स्पष्टीकरण इस प्रकार है \[--{\text{ }}2F{e^{3 + }} + {\text{ }}2{I^--} \to {\text{ }}2F{e^{2 + }} + {I_2} \uparrow {\text{ }}2F{e^{2 + }} + {\text{ }}{S_2}{O_2}^{ - 8} \to {\text{ }}2F{e^{3 + }} + {\text{ }}2S{O_2}^{ - 4}\]
12. अन्तराकाशी यौगिक क्या हैं? इस प्रकार के यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात क्यों हैं?
उत्तर: वे यौगिक जिनके क्रिस्टल जालक में अन्तराकाशी स्थलों को छोटे आकार वाले परमाणु अध्यासित कर लेते हैं, अन्तराकाशी यौगिक कहलाते हैं। अन्तराकाशी यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात होते हैं क्योंकि संक्रमण धातुओं के क्रिस्टल जालकों में उपस्थित रिक्तियों (voids) में छोटे आकार वाले परमाणु; जैसे- \[H,{\text{ }}N\] या \[C\] सरलता से सम्पाशित हो जाते हैं।
13. संक्रमण धातुओं की ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता असंक्रमण धातुओं में ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता से किस प्रकार भिन्न है? उदाहरण देकर स्पष्ट कीजिए।
उत्तर: संक्रमण धातुओं में ऑक्सीकरण अवस्था \[ + 1\] से एक के क्रमिक परिवर्तन से उच्च अवस्थाओं में परिवर्तित होती है। जैसे, मैंगनीज में यह \[ + 2,{\text{ }} + 3,{\text{ }} + 4,{\text{ }} + 5,{\text{ }} + 6,{\text{ }} + 7\] पायी जाती है। असंक्रमण धातुओं में परिवर्तन चयनात्मक होता है तथा सामान्य रूप से 2 के अन्तर से परिवर्तित होता है, जैसे क्लोरीन में परिवर्तन क्रम \[ - 1,{\text{ }} + 1, + 3,{\text{ }} + 5,{\text{ }} + 7\] है।
14. आयरन क्रोमाइट अयस्क से पोटैशियम डाइक्रोमेट बनाने की विधि का वर्णन कीजिए। पोटैशियम डाइक्रोमेट विलयन पर pH बढ़ाने से क्या प्रभाव पड़ेगा?
उत्तर: पोटैशियम डाइक्रोमेट बनाने की विधि (Method of Preparation of Potassium Dichromate) – आयरन क्रोमाइट अयस्क \[\left( {FeC{r_2}{O_4}} \right)\] को जब वायु की उपस्थिति में सोडियम यो पोटैशियम कार्बोनेट के साथ संगलित किया जाता है तो क्रोमेट प्राप्त होता है। \[4FeC{r_2}{O_4} + {\text{ }}8N{a_2}C{O_3} + {\text{ }}7{O_2} \to {\text{ }}8N{a_2}Cr{O_4} + 2F{e_2}{O_3} + {\text{ }}8C{O_2} \uparrow \] सोडियम क्रोमेट के पीले विलयन को छानकर उसे सल्फ्यूरिक अम्ल द्वारा अम्लीय बना लिया जाता है। जिसमें से नारंगी सोडियम डाइक्रोमेट, Na2Cr2O7 . 2H2O को क्रिस्टलित कर लिया जाता है। \[2N{a_2}Cr{O_4} + {\text{ }}2{H^ + } \to {\text{ }}N{a_2}C{r_2}{O_7} + {\text{ }}2N{a^ + } + {\text{ }}{H_2}O\] सोडियम डाइक्रोमेट की विलेयता, पोटैशियम डाइक्रोमेट से अधिक होती है, इसलिए सोडियम डाइक्रोमेट के विलयन में पोटैशियम क्लोराइड डालकर पोटैशियम डाइक्रोमेट प्राप्त कर लिया जाता है। \[N{a_2}C{r_2}{O_7} + {\text{ }}2KCl{\text{ }} \to {\text{ }}{K_2}C{r_2}{O_7} + {\text{ }}2NaCl\] पोटैशियम डाइक्रोमेट के नारंगी रंग के क्रिस्टल, क्रिस्टलीकृत हो जाते हैं। जलीय विलयन में क्रोमेट तथा डाइक्रोमेट का अन्तरारूपान्तरण होता है जो विलयन के pH पर निर्भर करता है। क्रोमेट तथा डाइक्रोमेट में क्रोमियम की ऑक्सीकरण संख्या समान है। \[2Cr{O_2}^{ - 4} + {\text{ }}2{H^ + } \to {\text{ }}C{r_2}{O_2}^{ - 7} + {\text{ }}{H_2}O{\text{ }}C{r_2}{O_2}^{ - 7} + {\text{ }}2O{H^--} \to {\text{ }}2Cr{O_2}^{ - 4} + {\text{ }}{H_2}O\] अत: pH बढ़ाने पर, अर्थात् विलयन को क्षारीय करने पर, डाइक्रोमेट आयन (नारंगी रंग) क्रोमेट आयनों में परिवर्तित हो जाते हैं तथा विलयन का रंग पीला हो जाता है।
15. पोटैशियम डाइक्रोमेट की ऑक्सीकरण क्रिया का उल्लेख कीजिए तथा निम्नलिखित के साथ आयनिक समीकरण लिखिए- आयोडाइड आयन आयरन (II) विलयन \[{H_2}S\].
उत्तर: पोटैशियम डाइक्रोमेट प्रबल ऑक्सीकारक के रूप में कार्य करता है। इसका उपयोग आयतनमितीय विश्लेषण में प्राथमिक मानक के रूप में किया जाता है। अम्लीय माध्यम में डाइक्रोमेट आयन की ऑक्सीकरण क्रिया निम्नलिखित प्रकार से प्रदर्शित की जा सकती है – \[C{r_2}{O_2}^{ - 7} + {\text{ }}14{H^ + } + {\text{ }}6{e^--} \to {\text{ }}2C{r^{3 + }} + {\text{ }}7{H_2}O{\text{ }}\left( {E-- = 1:{\text{ }}33{\text{ }}V} \right)\] आयनिक अभिक्रियाएँ (Ionic Reactions) आयोडाइड आयन के साथ (With iodide ion) – Cr2O2-7 + 14H+ + 6I– → 2Cr3+ + 7H2O + 3I2 ↑ आयरन (II) विलयन के साथ (With Iron (II) solution) \[C{r_2}{O_2}^{ - 7} + {\text{ }}14{H^ + } + {\text{ }}6F{e^{2 + }} \to {\text{ }}2C{r^{3 + }} + {\text{ }}7{H_2}O{\text{ }} + {\text{ }}6F{e^{3 + }}\]
${H_2}S$ के साथ (With \[{H_2}S\]) \[C{r_2}{O_2}^{ - 7} + {\text{ }}8{H^ + } + {\text{ }}3{H_2}S{\text{ }} \to {\text{ }}2C{r^{3 + }} + {\text{ }}7{H_2}O{\text{ }} + {\text{ }}3S{\text{ }} \downarrow \]
16. पोटैशियम परमैंगनेट को बनाने की विधि का वर्णन कीजिए। अम्लीय पोटैशियम परमैंगनेट किस प्रकार आयरन (II) आयन, \[S{O_2}\] तथा ऑक्सैलिक अम्ल से अभिक्रिया करता है? अभिक्रियाओं के लिए आयनिक समीकरण लिखिए।
उत्तर: पोटैशियम परमैंगनेट, \[KMn{O_4}\] (Potassium Permanganate, \[KMn{O_4}\]) बनाने की विधि (Method of Preparation) – पोटैशियम परमैंगनेट को निम्नलिखित विधियों से। बनाया जा सकता है
पोटैशियम परमैंगनेट को प्राप्त करने के लिए \[Mn{O_2}\] को क्षारीय धातु हाइड्रॉक्साइड तथा \[KN{O_3}\] जैसे ऑक्सीकारक के साथ संगलित किया जाता है। इससे गाढ़े हरे रंग का उत्पाद K2MnO4 प्राप्त होता है जो उदासीन या अम्लीय माध्यम में असमानुपातित होकर पोटैशियम परमैंगनेट देता है। \[2Mn{O_2} + {\text{ }}4KOH{\text{ }} + {\text{ }}{O_2} \to {\text{ }}2{K_2}Mn{O_4} + {\text{ }}2{H_2}O{\text{ }}3Mn{O_2}^{ - 4} + {\text{ }}4{H^ + } \to {\text{ }}2Mn{O^{--4}} + {\text{ }}Mn{O_2} + {\text{ }}2{H_2}O\]
औद्योगिक स्तर पर इसका उत्पादन \[Mn{O_2}\] के क्षारीय ऑक्सीकरणी संगलन के पश्चात् मैंगनेट (VI) के विद्युत-अपघटनी ऑक्सीकरण द्वारा किया जाता है।

प्रयोगशाला में मैंगनीज (II) आयन के लवण परऑक्सीडाइसल्फेट द्वारा ऑक्सीकृत होकर परमैंगनेट बनाते हैं। \[2M{n^{2 + }} + {\text{ }}5{S_2}{O_2}^{ - 8} + {\text{ }}8{H_2}O{\text{ }} \to {\text{ }}2Mn{O^{--4}} + {\text{ }}10S{O_2}^{ - 4} + {\text{ }}16{H^ + }\] रासायनिक अभिक्रियाएँ (Chemical Reactions) अम्लीय पोटैशियम परमैंगनेट की रासायनिक अभिक्रियाएँ निम्नलिखित हैं – आयरन (II) आयन के साथ (With Iron (II) ion) \[Mn{O^{--4}} + {\text{ }}8{H^ + } + {\text{ }}5F{e^{2 + }} \to {\text{ }}M{n^{2 + }} + {\text{ }}4{H_2}O{\text{ }} + {\text{ }}5F{e^{3 + }}S{O_2}\] के साथ (With \[S{O_2}\]) \[2Mn{O_4} + {\text{ }}2{H_2}O{\text{ }} + {\text{ }}5S{O_2} \to {\text{ }}2M{n^{2 + }} + {\text{ }}4{H^ + } + {\text{ }}5S{O_2}^{ - 4}\] ऑक्सैलिक अम्ल के साथ (With oxalic acid)
${\text{CO}}{{\text{O}}^ - }2{\text{MnO}}_4^ - + 16{{\text{H}}^ + } + 5\mid \overrightarrow {{\text{COO}}} 2{\text{M}}{{\text{n}}^{2 + }} + 8{{\text{H}}_2}{\text{O}} + 10{\text{C}}{{\text{O}}_2} \uparrow $
17. \[{M^{2 + }}/M\] तथा \[{M^{3 + }}/{M^{2 + }}\] निकाय के सन्दर्भ में कुछ धातुओं के \[E--\]के मान नीचे दिए गए हैं।
$Cr^{2+}/Cr-0.9 V\\Cr^{3}/cr^{2+}-0.4V\\Mn^{2+}/Mn-1.2 V\\Mn^{3+}/Mn^{2+}-1.5 v\\Fe^{2+}/Fe-0.4V\\Fe^{3+}/Fe^{2+}+0.8 V$
उपर्युक्त आँकड़ों के आधार पर निम्नलिखित पर टिप्पणी कीजिए – अम्लीय माध्यम में \[C{r^{3 + }}\] या \[M{n^{3 + }}\] की तुलना में \[F{e^{3 + }}\] का स्थायित्व। समान प्रक्रिया के लिए क्रोमियम अथवा मैंगनीज धातुओं की तुलना में आयरन के ऑक्सीकरण में सुगमता।
उत्तर: \[C{r^{3 + }}/{\text{ }}C{r^{2 + }}\] के लिए E का मान ऋणात्मक है। इसलिए \[C{r^{3 + }}\] स्थायी है तथा \[C{r^{2 + }}\] में अपचयित नहीं हो सकता है। \[M{n^{3 + }}/{\text{ }}M{n^{2 + }}\] के लिए \[{E^--}\] का मान अधिक धनात्मक है, इसलिए \[M{n^{3 + }}\] बहुत स्थायी नहीं है तथा सरलता से \[M{n^{2 + }}\] में अपचयित हो सकता है। \[F{e^{3 + }}/{\text{ }}F{e^{2 + }}\] के लिए E- का मान कम धनात्मक लेकिन छोटा है। इसलिए \[F{e^{3 + }},{\text{ }}M{n^{3 + }}\] से अधिक स्थायी है। लेकिन यह \[C{r^{2 + }}\] से कम स्थायी है। \[Fe,{\text{ }}Cr\] तथा Mn के लिए ऑक्सीकरण विभव क्रमशः \[ + 0.4{\text{ }}V,{\text{ }} + {\text{ }}0.9{\text{ }}V\] तथा \[ + 1.2{\text{ }}V\] है। इसलिए इनके ऑक्सीकरण की सुलभता का क्रम \[Mn{\text{ }} > {\text{ }}Cr{\text{ }} > {\text{ }}Fe\] होगा।
18. निम्नलिखित में कौन-से आयन जलीय विलयन में रंगीन होंगे? \[\mathbf{T{i^{3 + }},{\text{ }}{V^{3 + }},{\text{ }}C{u^ + },{\text{ }}S{c^{3 + }},{\text{ }}M{n^{2 + }},{\text{ }}F{e^{3 + }},C{o^{2 + }}}\] प्रत्येक के लिए कारण बताइए।
उत्तर: वे आयन रंगीन होते हैं जिनमें एक या अधिक अयुग्मित इलेक्ट्रॉन होते हैं। \[T{i^{3 + }},{\text{ }}{V^{3 + }},{\text{ }}M{n^{2 + }},{\text{ }}F{e^{3 + }}\] तथा \[C{o^{2 + }}\] रंगीन होते हैं। \[C{u^ + },S{c^{3 + }}\] रंगहीन होते हैं।
19. प्रथम संक्रमण श्रेणी की धातुओं की \[ + 2\] ऑक्सीकरण अवस्थाओं के स्थायित्व की तुलना कीजिए।
उत्तर: प्रथमें संक्रमण श्रेणी के प्रथम अर्द्धभाग में बढ़ते हुए परमाणु क्रमांक के साथ प्रथम तथा द्वितीय आयनन एन्थैल्पियों का योग बढ़ता है। अत: मानक अपचायक विभव \[\left( {{E^--}} \right)\] कम तथा ऋणात्मक होता है। इसलिए \[{M^{2 + }}\] आयन बनाने की प्रवृत्ति घटती है। अत: \[ + 2\] ऑक्सीकरण अवस्था प्रथम अर्द्ध-भाग में अधिक स्थायी होती है। \[ + 2\] ऑक्सीकरण अवस्था का अधिक स्थायित्व, \[M{n^{2 + }}\] में अर्द्धपूरित \[d - \] उपकोशों \[\left( {{d^5}} \right)\] के कारण, \[Z{n^{2 + }}\] में पूर्णपूरित \[d - \]उपकोशों \[\left( {{d^{10}}} \right)\] के कारण तथा निकिल में उच्च ऋणात्मक जलयोजन एन्थैल्पी के कारण होता है।
20. निम्नलिखित के सन्दर्भ में लैन्थेनाइड एवं ऐक्टिनाइड के रसायन की तुलना कीजिए – इलेक्ट्रॉनिक विन्यास परमाण्वीय एवं आयनिक आकार ऑक्सीकरण अवस्था रासायनिक अभिक्रियाशीलता।
उत्तर :
इलेक्ट्रॉनिक विन्यास (Electronic configuration) – लैन्थेनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास \[\left[ {Xe} \right]54{\text{ }}4{f^{1 - 14}}5{d^{0 - 1}}6{s^2}\] होता है, जबकि ऐक्टिनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास \[\left[ {Rn} \right]86{\text{ }}5{f^{1 - 14}}6{d^{1 - 2}}7{s^2}\] होता है। अतः लैन्थेनाइड \[4f\] श्रेणी से तथा ऐक्टिनाइड 5f श्रेणी से सम्बद्ध होते हैं।
परमाण्वीय एवं आयनिक आकार (Atomic and ionic sizes) – लैन्थेनाइड तथा ऐक्टिनाइड दोनों \[ + 3\] ऑक्सीकरण अवस्था में अपने परमाणुओं अथवा आयनों के आकारों में कमी प्रदर्शित करते हैं। लैन्थेनाइडों में यह कमी लैन्थेनाइड आकुंचन कहलाती है, जबकि ऐक्टिनाइडों में यह ऐक्टिनाइड आकुंचन कहलाती है। यद्यपि ऐक्टिनाइडों में एक तत्व से दूसरे तत्व तक \[5f - \] इलेक्ट्रॉनों द्वारा अत्यन्त कम परिरक्षण प्रभाव के कारण आकुंचन उत्तरोत्तर बढ़ता है।
ऑक्सीकरण अवस्था (Oxidation states) – लैन्थेनाइड सीमित ऑक्सीकरण अवस्थाएँ \[\left( { + 2,{\text{ }} + {\text{ }}3,{\text{ }} + 4} \right)\] प्रदर्शित करते हैं जिनमें \[ + 3\] ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण \[4f,{\text{ }}5d\] तथा \[6s\] उपकोशों के बीच अधिक ऊर्जा-अन्तर होना है। दूसरी ओर ऐक्टिंनाइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं क्योंकि \[5f,6d\] तथा \[7s\] उपकोशों में ऊर्जा-अन्तर कम होता है।
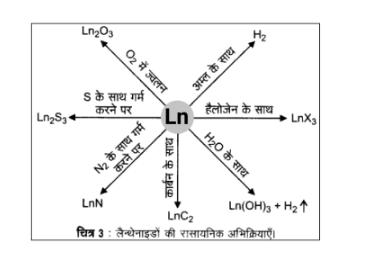
रासायनिक अभिक्रियाशीलता (Chemical reactivity) – लैन्थेनाइड (Lanthanides) सामान्य रूप से श्रेणी के आरम्भ वाले सदस्य अपने रासायनिक व्यवहार में कैल्सियम की तरह बहुत क्रियाशील होते हैं, परन्तु बढ़ते परमाणु क्रमांक के साथ ये ऐलुमिनियम की तरह व्यवहार करते हैं। अर्द्ध- अभिक्रिया \[L{n^{3 + }}\left( {aq} \right){\text{ }} + {\text{ }}3{e^--} \to {\text{ }}Ln\left( s \right)\] के लिए \[{E^--}\] का मान \[ - 2.2{\text{ }}V\] से \[ - 2.4{\text{ }}V\] के परास में है। \[Eu\] के लिए \[{E^--}\] का मान \[ - 2.0{\text{ }}V\] है। निस्सन्देह मान में थोड़ा-सा परिवर्तन है। हाइड्रोजन गैस के वातावरण में मन्द गति से गर्म करने पर ये धातुएँ हाइड्रोजन से संयोग कर लेती हैं। इन धातुओं को कार्बन के साथ गर्म करने पर कार्बाइड- \[L{n_3}C,{\text{ }}L{n_2}{C_3}\] तथा \[Ln{C_2}\] बनते हैं। ये तनु अम्लों से हाइड्रोजन गैस मुक्त करती हैं तथा हैलोजेन के वातावरण में जलने पर हैलाइड बनाती हैं। ये ऑक्साइड \[{M_2}{O_3}\] तथा हाइड्रॉक्साइड \[M{\left( {OH} \right)_3}\] बनाती हैं। हाइड्रॉक्साइड निश्चित यौगिक हैं न कि केवल हाइड्रेटेड (जलयोजित) ऑक्साइड। ये क्षारीय मृदा धातुओं के ऑक्साइड तथा हाइड्रॉक्साइड की भाँति क्षारकीय होते हैं। इनकी सामान्य अभिक्रियाएँ चित्र में प्रदर्शित की गई हैं।

ऐक्टिनाइड (Actinides) – ऐक्टिनाइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्मविभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। हाइड्रोक्लोरिक अम्ल सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा अल्प प्रभावित होती हैं, इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता।
21. आप निम्नलिखित को किस प्रकार से स्पष्ट करेंगे \[--{\text{ }}{d^4}\] स्पीशीज में से \[C{r^{2 + }}\] प्रबल अपचायक है, जबकि मैंगनीज (III) प्रबल ऑक्सीकारक है। जलीय विलयन में कोबाल्ट (II) स्थायी है, परन्तु संकुलनकारी अभिकर्मकों की उपस्थिति में यह सरलतापूर्वक ऑक्सीकृत हो जाता है। आयनों का \[{d^1}\] विन्यास अत्यन्त अस्थायी है।
उत्तर: \[C{r^{2 + }}\] प्रबल ऑक्सीकारक होता है क्योंकि इसमें \[3{d^4}\] से \[3{d^3}\] का परिवर्तन निहित है। \[3{d^3}\] विन्यास \[\left( {{t_{32}}g} \right)\] अधिक स्थायी है। \[M{n^{3 + }}\] के ऑक्सीकारक गुणों में \[3{d^4}\] से \[3{d^5}\] का परिवर्तन होता है। तथा \[3{d^5}\] अधिक स्थायी विन्यास है। यही कारण है कि \[M{n^{3 + }}\] प्रबल ऑक्सीकारक है। जटिलीकरण (complexing) अभिकर्मकों की उपस्थिति में क्रिस्टल फील्ड स्थिरीकरण ऊर्जा (CFSE) कोबाल्ट की तृतीय आयनन एन्थैल्पी से अधिक होती है। इस प्रकार \[Co\left( {II} \right)\] सरलता से \[Co\left( {III} \right)\] में ऑक्सीकृत हो जाता है। वे आयन जिनमें \[{d^1}\] विन्यास होता है, वे d-उपकक्ष में उपस्थित इलेक्ट्रॉन को त्यागने की प्रवृत्ति रखते हैं तथा अधिक स्थायी \[{d^0}\] विन्यास प्राप्त कर लेते हैं। यह सरलता से सम्पन्न हो सकता है। क्योंकि जलयोजन या जालक ऊर्जा का मान \[d - \] उपकक्ष से इलेक्ट्रॉन के पृथक्कीकरण में निहित आयनन एन्थैल्पी से अधिक होता है। ‘
22. असमानुपातन से आप क्या समझते हैं? जलीय विलयन में असमानुपातन अभिक्रियाओं के दो उदाहरण दीजिए।
उत्तर: किसी रासायनिक अभिक्रिया के फलस्वरूप किसी पदार्थ का एक समय में ऑक्सीकरण व अपचयन समानुपातीकरण कहलाता है। इस प्रकार, पदार्थ की ऑक्सीकरण अवस्था बढ़ती भी है तथा घटती भी है। जैसे,
$3C{l_2} + 6O{H^ - } \to 5C{l^{ - 1}} + 5{H_2}O$
$3{\text{MnO}}_4^{2 - } + 4{{\text{H}}^ + } \to 2{\text{MnO}}_4^ - + {\text{Mn}}{{\text{O}}_2} + 2{{\text{H}}_2}{\text{O}}$
23. प्रथम संक्रमण श्रेणी में कौन-सी धातु बहुधा तथा क्यों \[ + 1\] ऑक्सीकरण अवस्था दर्शाती हैं?
उत्तर: \[Cu\left( {3{d^{10}}4{s^1}} \right)\] प्रायः \[ + 1\] ऑक्सीकरण अवस्था प्रदर्शित करता है तथा \[C{u^ + }\] आयन \[\left( {3{d^{10}}} \right)\] बनाता है, जिसकी अधिक स्थायी विन्यास होता है।
24. निम्नलिखित गैसीय आयनों में अयुग्मित इलेक्ट्रॉनों की गणना कीजिए – \[M{n^{3 + }},{\text{ }}C{r^{3 + }},{\text{ }}{V^{3 + }}\] तथा \[T{i^{3 + }}\] इनमें से कौन-सा जलीय विलयन में अतिस्थायी है?
उत्तर: \[M{n^{3 + }};{\text{ }}3{d^4}\] अयुग्मित इलेक्ट्रॉनों की संख्या \[ = {\text{ }}4\]
\[C{r^{3 + }};{\text{ }}3{d^3}\] अयुग्मित इलेक्ट्रॉनों की संख्या \[ = {\text{ }}3\]
\[{V^{3 + }};{\text{ }}3{d^3}\] अयुग्मित इलेक्ट्रॉनों की संख्या \[ = {\text{ }}2\]
\[T{i^{3 + }};{\text{ }}3{d^1}\] अयुग्मित इलेक्ट्रॉनों की संख्या \[ = {\text{ }}1\]
इनमें से \[C{r^{3 + }}\] जलीय विलयन में अतिस्थायी हैं, क्योंकि इनमें अर्द्धपूरित \[{t_2}g\] स्तर होता है।
25. उदाहरण देते हुए संक्रमण धातुओं के रसायन के निम्नलिखित अभिलक्षणों का कारण बताइए – संक्रमण धातु का निम्नतम ऑक्साइड क्षारकीय है, जबकि उच्चतम ऑक्साइड उभयधर्मी या अम्लीय है। संक्रमण धातु की उच्चतम ऑक्सीकरण अवस्था ऑक्साइडों तथा फ्लुओराइडों में। प्रदर्शित होती है। धातु के ऑक्सोऋणायनों में उच्चतम ऑक्सीकरण अवस्था प्रदर्शित होती है।
उत्तर: निम्नतम ऑक्साइड में संक्रमण धातु की ऑक्सीकरण अवस्था सबसे कम होती है। इसलिए ऑक्साइड क्षारीय होता है तथा उच्च ऑक्सीकरण अवस्था प्राप्त करने के लिए अम्ल से क्रिया कर ऑक्सीकृत होने की प्रवृत्ति रखता है। जबकि उच्चतम ऑक्साइड उच्च ऑक्सीकरण अवस्था में बनते हैं। परिणामस्वरूप, ये ऑक्साइड अम्लीय या उभयधर्मी होते हैं। संक्रमण धातु की उच्चतम ऑक्सीकरण अवस्था ऑक्साइडों तथा फ्लुओराइडों में प्रदर्शित होती है। क्योंकि ऑक्सीजन तथा फ्लुओरीन उच्च विद्युत ऋणात्मक तत्त्व हैं तथा आकर में छोटे होते हैं। ये प्रबल ऑक्सीकारक होते हैं। उदाहरणार्थ– ऑस्मियम, \[Os{F_6}\] में \[ + 6\] ऑक्सीकरण अवस्था प्रदर्शित करता है तथा वेनेडियम, \[{V_2}{O_5}\] में \[ + 5\] ऑक्सीकरण अवस्था प्रदर्शित करता है। धातु ऑक्सोऋणायनों में उच्च ऑक्सीकरण अवस्था प्रदर्शित होती है जैसे- \[C{r_2}{O_2}^{7 - }\] में \[Cr\] की ऑक्सीकरण अवस्था \[ + 6\] है, जबकि \[Mn{O_4}^ - \] में \[Mn\] की ऑक्सीकरण अवस्था \[ + 7\] है। धातु का ऑक्सीजन से संयोग का कारण यह है कि ऑक्सीजन उच्च विद्युत ऋणात्मक तथा ऑक्सीकरक तत्त्व है।
26. निम्नलिखित को बनाने के लिए विभिन्न पदों का उल्लेख कीजिए – क्रोमाइट अयस्क से \[{K_2}C{r_2}{O_7}\] पाइरोलुसाइट से \[KMn{O_4}\]
उत्तर:
क्रोमाइट अयस्क से \[{K_2}C{r_2}{O_7}({K_2}C{r_2}{O_7}\] from chromite ore) –पोटैशियम डाइक्रोमेट बनाने की विधि (Method of Preparation of Potassium Dichromate) – आयरन क्रोमाइट अयस्क \[\left( {FeC{r_2}{O_4}} \right)\] को जब वायु की उपस्थिति में सोडियम यो पोटैशियम कार्बोनेट के साथ संगलित किया जाता है तो क्रोमेट प्राप्त होता है।
$4{\text{FeC}}{{\text{r}}_2}{{\text{O}}_4} + 16{\text{NaOH}} + 7{{\text{O}}_2} \to 8{\text{N}}{{\text{a}}_2}{\text{Cr}}{{\text{O}}_4} + 2{\text{F}}{{\text{e}}_2}{{\text{O}}_3} + 8{{\text{H}}_2}{\text{O}}$
सोडियम क्रोमेट के पीले विलयन को छानकर उसे सल्फ्यूरिक अम्ल द्वारा अम्लीय बना लिया जाता है। जिसमें से नारंगी सोडियम डाइक्रोमेट, Na2Cr2O7.2H2O को क्रिस्टलित कर लिया जाता है।
$2{\text{N}}{{\text{a}}_2}{\text{C}}{{\text{r}}_2}{{\text{O}}_4} + {{\text{H}}_2}{\text{S}}{{\text{O}}_4}{\text{ }} \to {\text{N}}{{\text{a}}_2}{\text{C}}{{\text{r}}_2}{{\text{O}}_7} + {\text{N}}{{\text{a}}_2}{\text{S}}{{\text{O}}_4} + {{\text{H}}_2}{\text{O}}$
सोडियम डाइक्रोमेट की विलेयता, पोटैशियम डाइक्रोमेट से अधिक होती है, इसलिए सोडियम डाइक्रोमेट के विलयन में पोटैशियम क्लोराइड डालकर पोटैशियम डाइक्रोमेट प्राप्त कर लिया जाता है।
\[{\text{N}}{{\text{a}}_2}{\text{C}}{{\text{r}}_2}{{\text{O}}_7} + 2{\text{KCl}} \to {{\text{K}}_2}{\text{C}}{{\text{r}}_2}{{\text{O}}_7} + 2{\text{NaCl}}\]
पोटैशियम डाइक्रोमेट के नारंगी रंग के क्रिस्टल, क्रिस्टलीकृत हो जाते हैं। जलीय विलयन में क्रोमेट तथा डाइक्रोमेट का अन्तरारूपान्तरण होता है जो विलयन के pH पर निर्भर करता है। क्रोमेट तथा डाइक्रोमेट में क्रोमियम की ऑक्सीकरण संख्या समान है।
\[2Cr{O_2}^{ - 4} + {\text{ }}2{H^ + } \to {\text{ }}C{r_2}{O_0}^{ - 7} + {\text{ }}{H_2}O{\text{ }}C{r_2}{O_2}^{ - 7} + {\text{ }}2O{H_--} \to {\text{ }}2Cr{O_2}^{ - 4} + {\text{ }}{H_2}O\]
अत: pH बढ़ाने पर, अर्थात् विलयन को क्षारीय करने पर, डाइक्रोमेट आयन (नारंगी रंग) क्रोमेट आयनों में परिवर्तित हो जाते हैं तथा विलयन का रंग पीला हो जाता है।पाइरोलुसाइट से \[KMn{O_4}(KMn{O_4}\] from pyrolusite) – औद्योगिक स्तर पर इसका उत्पादन \[Mn{O_2}\] के क्षारीय ऑक्सीकरणी संगलन के पश्चात् मैंगनेट (VI) के विद्युत-अपघटनी ऑक्सीकरण द्वारा किया जाता है।
27. मिश्रातुएँ क्या हैं? लैन्थेनाइड धातुओं से युक्त एक प्रमुख मिश्रातु का उल्लेख कीजिए। इसके उपयोग भी बताइए।
उत्तर: दो या दो से अधिक धातुओं या धातुओं व अधातुओं का समांग मिश्रण मिश्रातु कहलाती है। मिश धातु एक महत्त्वपूर्ण मिश्रातु है, जिसमें \[30 - 35\% \] सीरियम तथा कुछ मात्रा में अन्य हल्की लैन्थेनाइड धातु \[Zr\] होती है। यह धातुकर्म में अपचायक के रूप में प्रयोग होती है। \[30\% \] मिश्रातु तथा \[1\% {\text{ }}Zr\] धातु युक्त मैग्नीशियम मिश्रातु का प्रयोग जेट इंजन में किया जाता है।
28. आन्तरिक संक्रमण तत्व क्या हैं? बताइए कि निम्नलिखित में कौन-से परमाणु क्रमांक आन्तरिक संक्रमण तत्वों के हैं – \[29,{\text{ }}59,{\text{ }}74,{\text{ }}95,{\text{ }}102,{\text{ }}104\]
उत्तर: वे तत्त्व जिनमें विभेदी इलेक्ट्रॉन \[\left( {n{\text{ }}--{\text{ }}2} \right){\text{ }}f\] उपकक्षक में प्रवेश करता है, अन्त: संक्रमण तत्त्व कहलाते हैं। दिये गये तत्त्वों में \[59,95\] तथा \[102\] परमाणु क्रमांक वाले तत्त्व अन्त: संक्रमण तत्त्व हैं।
29. ऐक्टिनाइड तत्वों का रसायन उतना नियमित नहीं है जितना कि लैन्थेनाइड तत्वों का रसायन। इन तत्वों की ऑक्सीकरण अवस्थाओं के आधार पर इस कथन का आधार प्रस्तुत कीजिए।
उत्तर: लैन्थेनाइडों की ऑक्सीकरण अवस्थाएँ \[ + 2,{\text{ }} + 3\] तथा \[ + 4\] हैं। इनमें से \[ + 3\] अवस्था सर्वाधिक सामान्य है। ऑक्सीकरण अवस्थाओं की सीमित संख्या का कारण \[4f,{\text{ }}5d\] तथा \[6s\] उपकक्षाओं के बीच अधिक ऊर्जा अन्तर होना है। इसके विपरीत, ऐक्टिनाइड अनेक ऑक्सीकरण अवस्थाएँ जैसे \[ + 2,{\text{ }} + 3,{\text{ }} + 4,{\text{ }} + 5,{\text{ }} + 6\] तथा \[ + 7\] प्रदर्शित करते हैं, यद्यपि इनकी सामान्य अवस्था \[ + 3\] होती है। इसका कारण यह है कि \[5f,{\text{ }}6d\] तथा \[7s\] उपकक्षाओं के बीच ऊर्जा का अन्तर कम होता है।
30. ऐक्टिनाइड श्रेणी का अन्तिम तत्व कौन-सा है? इस तत्व का इलेक्ट्रॉनिक विन्यास लिखिए। इस तत्व की सम्भावित ऑक्सीकरण अवस्थाओं पर टिप्पणी कीजिए।
उत्तर: ऐक्टिनाइड श्रेणी का अन्तिम तत्त्व लॉरेन्शियम \[\left( {Lr} \right)\] है तथा इसका परमाणु क्रमांक \[103\] होता है। इसका इलेक्ट्रॉनिक विन्यास \[\left[ {Rn} \right]5{f^{14}}6{d^1}7{s^2}\] है तथा सम्भावित ऑक्सीकरण अवस्था \[ + 3\] है।
31. हुण्ड-नियम के आधार पर \[C{e^{3 + }}\] आयन के इलेक्ट्रॉनिक विन्यास को व्युत्पन्न कीजिए तथा ‘प्रचक्रण मात्र सूत्र के आधार पर इसके चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर: \[Ce\] तथा \[C{e^{3 + }}\] आयन का इलेक्ट्रॉनिक विन्यास निम्न है –
\[Ce{\text{ }}\left( {Z{\text{ }} = {\text{ }}58} \right){\text{ }}:{\text{ }}1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2}4{p^6}4{d^{10}}4{f^1}5{s^2}5{p^6}5{d^1}6{s^2}\]
या \[\left[ {Xe} \right]{\text{ }}4{f^1}5{d^1}6{s^2}\]
\[C{e^{3 + }}\left( {Z{\text{ }} = {\text{ }}55} \right):{\text{ }}\left[ {Xe} \right]4{f^1}\]
इस प्रकार \[C{e^ + }\] में केवल एक अयुग्मित इलेक्ट्रॉन होता है, अर्थात्
$\begin{gathered} n = 1 \hfill \\ \therefore {\mu _s} = \sqrt {n(n + 2)} BM = \sqrt {1\times (1 + 2)} = \sqrt 3 = 1.732BM \hfill \\ \end{gathered} $
32. लैन्थेनाइड श्रेणी के उन सभी तत्वों का उल्लेख कीजिए जो \[ + 4\] तथा जो \[ + 2\] ऑक्सीकरण अवस्थाएँ दर्शाते हैं। इस प्रकार के व्यवहार तथा उनके इलेक्ट्रॉनिक विन्यास के बीच सम्बन्ध स्थापित कीजिए।
उत्तर: \[ + 4\] ऑक्सीकरण अवस्था: \[Ce,{\text{ }}Pr,{\text{ }}Nd,{\text{ }}Tb,\;Dy\]
\[ + 2\] ऑक्सीकरण अवस्था: \[Ce,{\text{ }}Nd,{\text{ }}Sm,{\text{ }}Tm,\;Yb\]
ये तत्त्व \[ + 2\] ऑक्सीकरण अवस्था उस समय प्रदर्शित करते हैं जब इनका इलेक्ट्रॉनिक विन्यास \[5{d^0}6{s^2}\] होता है। इसके विपरीत, \[ + 4\] अवस्था उस समय प्रदर्शित की जाती है जब इनका शेष विन्यास 4f0 के समीप (जैसे \[4{f^1},{\text{ }}4{f^2},{\text{ }}4{f^3}\]) या \[4{f^7}\] की समीप (जैसे \[4{f^8},{\text{ }}4{f^9}\]) होता है।
33. निम्नलिखित के सन्दर्भ में ऐक्टिनाइड श्रेणी के तत्वों तथा लैन्थेनाइड श्रेणी के तत्वों के रसायन की तुलना कीजिए –
(i) इलेक्ट्रॉनिक विन्यास
उत्तर: 1. इलेक्ट्रॉनिक विन्यास – लैन्थेनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास \[\left[ {Xe} \right]54{\text{ }}4{f^{1 - 14}}5{d^{0 - 1}}6{s^2}\] होता है, जबकि ऐक्टिनाइडों का सामान्य इलेक्ट्रॉनिक विन्यास \[\left[ {Rn} \right]86{\text{ }}5{f^{1 - 14}}6{d^{1 - 2}}7{s^2}\] होता है। अतः लैन्थेनाइड \[4f\] श्रेणी से तथा ऐक्टिनाइड \[5f\] श्रेणी से सम्बद्ध होते हैं।
(ii) ऑक्सीकरण अवस्थाएँ
2. ऑक्सीकरण अवस्था (Oxidation states) – लैन्थेनाइड सीमित ऑक्सीकरण अवस्थाएँ \[\left( { + 2,{\text{ }} + {\text{ }}3,{\text{ }} + 4} \right)\] प्रदर्शित करते हैं जिनमें \[ + 3\] ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण \[4f,{\text{ }}5d\] तथा \[6s\] उपकोशों के बीच अधिक ऊर्जा-अन्तर होना है। दूसरी ओर ऐक्टिंनाइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं क्योंकि \[5f,6d\] तथा \[7s\] उपकोशों में ऊर्जा-अन्तर कम होता है।
(iii) रासायनिक अभिक्रियाशीलता।
3. रासायनिक अभिक्रियाशीलता (Chemical reactivity) – लैन्थेनाइड (Lanthanides) सामान्य रूप से श्रेणी के आरम्भ वाले सदस्य अपने रासायनिक व्यवहार में कैल्सियम की तरह बहुत क्रियाशील होते हैं, परन्तु बढ़ते परमाणु क्रमांक के साथ ये ऐलुमिनियम की तरह व्यवहार करते हैं। अर्द्ध- अभिक्रिया \[L{n^{3 + }}\left( {aq} \right){\text{ }} + {\text{ }}3{e^--} \to {\text{ }}Ln\left( s \right)\] के लिए \[{E^--}\] का मान \[ - 2.2{\text{ }}V\] से \[ - 2.4{\text{ }}V\] के परास में है। \[Eu\] के लिए \[{E^ - }\] का मान \[ - 2.0{\text{ }}V\] है। निस्सन्देह मान में थोड़ा-सा परिवर्तन है। हाइड्रोजन गैस के वातावरण में मन्द गति से गर्म करने पर ये धातुएँ हाइड्रोजन से संयोग कर लेती हैं। इन धातुओं को कार्बन के साथ गर्म करने पर कार्बाइड- \[L{n_3}C,{\text{ }}L{n_2}{C_3}\] तथा \[Ln{C_2}\] बनते हैं। ये तनु अम्लों से हाइड्रोजन गैस मुक्त करती हैं तथा हैलोजेन के वातावरण में जलने पर हैलाइड बनाती हैं। ये ऑक्साइड \[{M_2}{O_3}\] तथा हाइड्रॉक्साइड \[M{\left( {OH} \right)_3}\] बनाती हैं। हाइड्रॉक्साइड निश्चित यौगिक हैं न कि केवल हाइड्रेटेड (जलयोजित) ऑक्साइड। ये क्षारीय मृदा धातुओं के ऑक्साइड तथा हाइड्रॉक्साइड की भाँति क्षारकीय होते हैं। इनकी सामान्य अभिक्रियाएँ चित्र में प्रदर्शित की गई हैं।
ऐक्टिनाइड (Actinides) – ऐक्टिनाइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्मविभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। हाइड्रोक्लोरिक अम्ल सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा अल्प प्रभावित होती हैं, इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता।
34. \[\mathbf{61,{\text{ }}91,{\text{ }}101}\] तथा \[109\] परमाणु क्रमांक वाले तत्वों का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर: \[Z{\text{ }} = {\text{ }}61\] (प्रोमिथियम, \[Pr\]) का इलेक्ट्रॉनिक विन्यास, \[\left[ {Xe} \right]54{\text{ }}4{f^5}5{d^0}6{s^2}\]
\[Z{\text{ }} = {\text{ }}91\] (प्रोटेक्टिनियम, \[Pa\]) का इलेक्ट्रॉनिक विन्यास, \[\left[ {Rn} \right]86{\text{ }}5{f^2}6{d^1}7{s^2}\]
\[Z{\text{ }} = {\text{ }}101\] (मेण्डेलीवियम, \[Md\]) का इलेक्ट्रॉनिक विन्यास \[\left[ {Rn} \right]86{\text{ }}5{f^{13}}6{d^0}7{s^2}\]
\[Z{\text{ }} = {\text{ }}109\] (मेटनेरियम, \[Mt\]) का इलेक्ट्रॉनिक विन्यास \[\left[ {Rn} \right]86{\text{ }}5{f^{14}}6{d^7}7{s^2}\]
35. प्रथम श्रेणी के संक्रमण तत्वों के अभिलक्षणों की द्वितीय एवं तृतीय श्रेणी के वर्गों के संगत तत्वों से क्षैतिज वर्गों में तुलना कीजिए। निम्नलिखित बिन्दुओं पर विशेष महत्त्व दीजिए – इलेक्ट्रॉनिक विन्यास ऑक्सीकरण अवस्थाएँ आयनन एन्थैल्पी तथा परमाण्वीय आकार।
उत्तर:
इलेक्ट्रॉनिक विन्यास (Electronic configuration) – एक ही वर्ग के तत्वों के इलेक्ट्रॉनिक विन्यास सामान्यतया समान होते हैं। यद्यपि प्रथम संक्रमण श्रेणी दो अपवाद प्रदर्शित करती है – \[Cr{\text{ }} = {\text{ }}3{d^5}4{s^1}\] तथा \[Cu{\text{ }} = {\text{ }}3{d^{10}}4{s^1}\], परन्तु द्वितीय श्रेणी इससे अधिक अपवाद प्रदर्शित करती है –
$Mo(42)=4d^{5}5s^{1};\\Tc(43)=4d^{6}5s^{1};\\Ru(44)=4d^{7}5s^{1};\\Rh(45)=4d^{8}5s^{1};\\Pd(46)=4d^{10}5s^{0};\\Ag(47)=4d^{10}5s^{1}$
${\text{ }}Pd{\text{ }}\left( {46} \right){\text{ }} = {\text{ }}4{d^{10}}5{s^0},{\text{ }}$
$Ag{\text{ }}\left( {47} \right){\text{ }} = {\text{ }}4{d^{10}}5{s^1}$
इसी प्रकार, तृतीय श्रेणी में \[W{\text{ }}\left( {74} \right){\text{ }} = {\text{ }}5{d^4}6{s^1},{\text{ }}Pt{\text{ }}\left( {78} \right){\text{ }} = {\text{ }}5{d^9}6{s^1}\] तथा \[Au{\text{ }}\left( {79} \right){\text{ }} = {\text{ }}5{d^{10}}6{s^1}\] अपवाद हैं। इसलिए क्षैतिज वर्ग में अनेक स्थितियों में, तीनों श्रेणियों के इलेक्ट्रॉनिक विन्यास समान नहीं हैं।
2. ऑक्सीकरण अवस्थाएँ (Oxidation states) – समान क्षैतिज वर्ग में तत्व सामान्यतया समान ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। प्रत्येक श्रेणी के मध्य में तत्वों द्वारा प्रदर्शित ऑक्सीकरण अवस्थाओं की संख्या अधिकतम होती है, जबकि अन्त में न्यूनतम होती है।
3. आयनन एन्थैल्पी (Ionization enthalpy) – प्रत्येक श्रेणी में बाएँ से दाएँ जाने पर प्रथम आयनन एन्थैल्पी सामान्यतया धीरे-धीरे बढ़ती है, यद्यपि प्रत्येक श्रेणी में कुछ अपवाद भी प्रेक्षित होते हैं। समान क्षैतिज वर्ग में \[3d\] श्रेणी के तत्वों की तुलना में \[4d\] श्रेणी के कुछ तत्वों की प्रथम आयनन एन्थैल्पी उच्च तथा कुछ तत्वों की कम होती है, यद्यपि \[5d\] श्रेणी की प्रथम आयनन एन्थैल्पी \[3d\] तथा \[4d\] श्रेणियों की तुलना में उच्च होती है। इसका कारण \[5d\] श्रेणी में \[4f\] इलेक्ट्रॉनों पर नाभिक का दुर्बल परिरक्षण प्रभाव है।
4. परमाण्वीय आकार (Atomic sizes) – सामान्यतया किसी श्रेणी में समान आवेश के आयन अथवा परमाणु, परमाणु क्रमांक बढ़ने के साथ त्रिज्याओं में क्रमिक कमी प्रदर्शित करते हैं, यद्यपि यह कमी अत्यन्त कम होती है। परन्तु \[4d\] श्रेणी के परमाणुओं के आकार, \[3d\] श्रेणी के सम्बन्धित तत्वों की तुलना में अधिक होते हैं, जबकि \[5d\] श्रेणी के सम्बन्धित तत्वों के आकार के लगभग समान होते हैं। इसका कारण लैन्थेनाइड आकुंचन है।
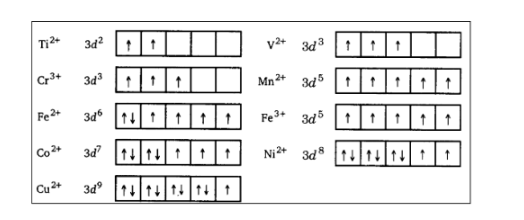
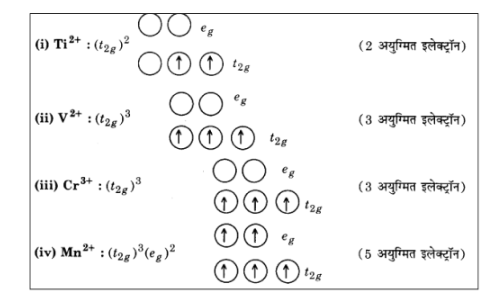
36. निम्नलिखित आयनों में प्रत्येक के लिए 3d इलेक्ट्रॉनों की संख्या लिखिए – \[T{i^{2 + }},{\text{ }}{V^{2 + }},{\text{ }}C{r^{3 + }},{\text{ }}M{n^{2 + }},{\text{ }}F{e^{2 + }},{\text{ }}F{e^{3 + }},{\text{ }}C{o^{2 + }},{\text{ }}N{i^{2 + }},{\text{ }}C{u^{2 + }}\] आप इन जलयोजित आयनों (अष्टफलकीय) में पाँच 3d कक्षकों को किस प्रकार अधिग्रहीत करेंगे? दर्शाइए।
उत्तर:

37. प्रथम संक्रमण श्रेणी के तत्व भारी संक्रमण तत्वों के अनेक गुणों से भिन्नता प्रदर्शित करते हैं। टिप्पणी कीजिए।
उत्तर: दिया गया कथन सत्य है। इस कथन के पक्ष में कुछ प्रमाण निम्नलिखित हैं – भारी संक्रमण तत्वों (\[4d\] तथा \[5d\] श्रेणियाँ) की परमाणु त्रिज्याएँ प्रथम संक्रमण श्रेणी के सम्बन्धित तत्वों की तुलना में अधिक होती हैं, यद्यपि \[4d\] तथा \[5d\] श्रेणियों की परमाणु त्रिज्याएँ लगभग समान होती हैं। \[5d\] श्रेणी की आयनन एन्थैल्पियाँ \[3d\] तथा \[4d\] श्रेणियों के सम्बन्धित तत्वों से उच्च होती हैं। \[4d\] तथा \[5d\] श्रेणियों की कणन एन्थैल्पियाँ प्रथम श्रेणी के सम्बन्धित तत्वों की तुलना में उच्च होती हैं। भारी संक्रमण तत्वों के गलनांक तथा क्वथनांक प्रथम संक्रमण श्रेणी की तुलना में अधिक होते हैं। इसका कारण इनमें प्रबल अन्तराधात्विक बन्धों की उपस्थिति है।
38. निम्नलिखित संकुल स्पीशीज के चुम्बकीय आघूर्णो के मान से आप क्या निष्कर्ष निकालेंगे?
उत्तर: यदि किसी जटिल यौगिक में अयुग्मित इलेक्ट्रॉन होते हैं, तो इसका चक्रण के कारण चुम्बकीय आघूर्ण निम्न प्रकार प्राप्त किया जा सकता है –
${\mu _s} = \sqrt {n(n + 2)} BM$
∴ जब
$n = 1,{\mu _s} = \sqrt {1(1 + 2)} = 1.73BM$
$n = 2,{\mu _s} = \sqrt {2(2 + 2)} = 2.83BM$
$n = 3,{\mu _s} = \sqrt {3(3 + 2)} = 3.87BM$
$n = 4,{\mu _s} = \sqrt {4(4 + 2)} = 4.9BM$
$n = 5,{\mu _s} = \sqrt {5(5 + 2)} = 5.92BM$
\[{K_4}\left[ {Mn{{\left( {CN} \right)}_6}} \right]\] का चुम्बकीय आघूर्ण \[2.2{\text{ }}BM\] है। इससे स्पष्ट है कि इसमें केवल एक अयुग्मित इलेक्ट्रॉन है। इस जटिल यौगिक में \[Mn\] की ऑक्सीकरण अवस्था \[ + 2\] है। अतएव यह \[M{n^{2 + }}\] के रूप में है। \[M{n^{2 + }}\] का अभिविन्यास \[3d\] होता है। एक अयुग्मित इलेक्ट्रॉन की उपस्थिति स्पष्ट करती है कि \[C{N^--}\] लीगैण्ड ने निम्नानुसार इलेक्ट्रॉनों को हुण्ड के नियम के विपरीत युग्मित कर दिया है –
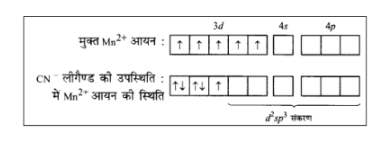
इस प्रकार यह निष्कर्ष निकाला जा सकता है कि \[C{N^--}\] एक प्रबल लीगैण्ड है तथा जटिल यौगिक के बनने में \[{d^2}s{p^3}\] संकरण होता है। अत: जटिल यौगिक एक आन्तरिक ऑर्बिटल अष्टफलकीय जटिल यौगिक है।
\[{\left[ {Fe{{\left( {{H_2}O} \right)}_6}} \right]^{2 + }}\] का चुम्बकीय आघूर्ण \[5.3\] है। इससे स्पष्ट है कि इसमें $4$ अयुग्मित इलेक्ट्रॉन हैं। इसमें \[Fe\] की ऑक्सीकरण अवस्था \[ + 2\] है। इस प्रकार यह \[F{e^{2 + }}\] आयन के रूप में है, जिसको अभिविन्यास \[3{d^6}\] है। यौगिक में $4$ अयुग्मित इलेक्ट्रॉन की उपस्थिति सिद्ध करती है कि \[{H_2}O\] लीगैण्ड दुर्बल है तथा इलेक्ट्रॉनों को युग्मित करने में असमर्थ है।
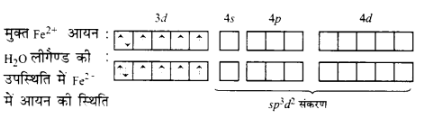
इस प्रकार, यह निष्कर्ष निकलता है कि \[{H_2}O\] एक दुर्बल लीगण्ड है तथा इसमें \[s{p^3}{d^2}\] संकरण होता है। यह एक बाह्य ऑर्बिटल अष्टफलकीय जटिल यौगिक है।
\[{K_2}\left[ {MnC{l_4}} \right]\] का चुम्बकीय आघूर्ण \[5.9\] है, जिससे स्पष्ट है कि इसमें \[5\] अयुग्मित इलेक्ट्रॉन हैं। \[Mn\] की ऑक्सीकरण अवस्था \[ + 2\] है। अत: यह \[M{n^{2 + }}\] अवस्था में है तथा इसका विन्यास \[3{d^5}\] है। अयुग्मित इलेक्ट्रॉनों की उपस्थिति से स्पष्ट है कि \[C{l^--}\] दुर्बल लीगैण्ड है तथा इलेक्ट्रॉन का युग्मन करने में असमर्थ है।
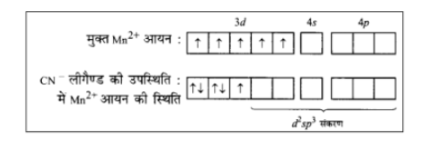
इस प्रकार यह निष्कर्ष निकलता है कि \[C{l^--}\] एक दुर्बल लीगैण्ड है तथा जटिल यौगिक में \[s{p^3}\] संकरण है। अतएव यह एक समचतुष्फलकीय जटिल यौगिक है।
NCERT Solutions for Class 12 Chemistry Chapter 8 The d and f Block Elements in Hindi Medium
Chapter-wise NCERT Solutions are provided everywhere on the internet with an aim to help the students to gain a comprehensive understanding. Class 12 Chemistry Chapter 8 solution Hindi medium is created by our in-house experts keeping the understanding ability of all types of candidates in mind. NCERT textbooks and solutions are built to give a strong foundation to every concept. These NCERT Solutions for Class 12 Chemistry Chapter 8 in Hindi ensure a smooth understanding of all the concepts including the advanced concepts covered in the textbook.
NCERT Solutions for Class 12 Chemistry Chapter 8 in Hindi medium PDF download are easily available on our official website (vedantu.com). Upon visiting the website, you have to register on the website with your phone number and email address. Then you will be able to download all the study materials of your preference in a click. You can also download the Class 12 Chemistry The d and f Block Elements solution Hindi medium from Vedantu app as well by following the similar procedures, but you have to download the app from Google play store before doing that.
NCERT Solutions in Hindi medium have been created keeping those students in mind who are studying in a Hindi medium school. These NCERT Solutions for Class 12 Chemistry The d and f Block Elements in Hindi medium pdf download have innumerable benefits as these are created in simple and easy-to-understand language. The best feature of these solutions is a free download option. Students of Class 12 can download these solutions at any time as per their convenience for self-study purpose.
These solutions are nothing but a compilation of all the answers to the questions of the textbook exercises. The answers/solutions are given in a stepwise format and very well researched by the subject matter experts who have relevant experience in this field. Relevant diagrams, graphs, illustrations are provided along with the answers wherever required. In nutshell, NCERT Solutions for Class 12 Chemistry in Hindi come really handy in exam preparation and quick revision as well prior to the final examinations.
FAQs on NCERT Solutions For Class 12 Chemistry in Hindi Chapter 8 The D And F Block Elements In Hindi Mediem (2025-26)
1. Where can I find reliable, step-by-step NCERT Solutions for Class 12 Chemistry Chapter 8, The d- and f-Block Elements?
Vedantu provides comprehensive NCERT Solutions for Class 12 Chemistry Chapter 8, The d- and f-Block Elements, fully updated for the CBSE 2025-26 syllabus. These solutions are crafted by subject matter experts to offer clear, step-by-step explanations for all in-text and exercise questions, ensuring you understand the correct methodology for solving problems.
2. How do the NCERT Solutions explain the method for writing the electronic configuration of ions from d-block elements?
The NCERT Solutions provide a clear, step-by-step method. First, you write the electronic configuration of the neutral atom. Then, you remove the required number of electrons, starting from the outermost ns orbital first, followed by the (n-1)d orbital. For example, to find the configuration of Fe²⁺, you start with Fe ([Ar] 3d⁶ 4s²) and remove two electrons from the 4s orbital, resulting in [Ar] 3d⁶.
3. What are the key steps outlined in the NCERT solutions for the preparation of Potassium Dichromate (K₂Cr₂O₇) from chromite ore?
The solutions detail the preparation of Potassium Dichromate in three main steps as per the NCERT textbook methodology:
- Step 1: Fusion of chromite ore (FeCr₂O₄) with sodium carbonate in the presence of air to form sodium chromate (Na₂CrO₄).
- Step 2: Conversion of the sodium chromate solution into sodium dichromate (Na₂Cr₂O₇) by acidification with sulphuric acid.
- Step 3: Treatment of the sodium dichromate solution with potassium chloride (KCl) to crystallise the less soluble potassium dichromate.
4. How do the NCERT Solutions for Chapter 8 help in understanding why transition metals exhibit variable oxidation states?
The solutions explain that the energy difference between the (n-1)d and ns orbitals in transition elements is very small. Consequently, electrons from both orbitals can participate in bond formation. The solutions provide examples, like Manganese (Mn), which can show oxidation states from +2 (using only 4s electrons) to +7 (using all 4s and 3d electrons), helping students grasp the underlying electronic reason for this key property.
5. Beyond its definition, how do the solutions explain the consequences of Lanthanoid Contraction?
The solutions elaborate on the significant consequences of lanthanoid contraction, which are crucial for board exams:
- Similarity in properties: It explains why the atomic radii of the second (4d) and third (5d) transition series are nearly identical, leading to similar chemical properties (e.g., Zr and Hf).
- Basicity of hydroxides: It clarifies why the basic strength of lanthanoid hydroxides decreases from La(OH)₃ to Lu(OH)₃ as the ionic size decreases across the series.
- Difficulty in separation: This similarity in size and properties makes the separation of lanthanoids from each other in their pure form a very difficult process.
6. How do the solutions clarify why Zinc (Zn), Cadmium (Cd), and Mercury (Hg) are not considered typical transition elements?
The NCERT Solutions clearly state that transition elements must have an incompletely filled d-orbital in their ground state or any of their common oxidation states. The solutions demonstrate that Zinc, Cadmium, and Mercury have a completely filled d-orbital (d¹⁰ configuration) in both their ground state and their most common oxidation state (+2). Therefore, they do not meet the official definition of a transition element.
7. Why is it crucial to follow the stepwise method in the NCERT Solutions for problems on redox reactions involving KMnO₄ and K₂Cr₂O₇?
Following the stepwise method is vital because these are complex redox reactions. The solutions break down the process into manageable steps:
- Writing the correct ionic half-reactions for the oxidant (e.g., MnO₄⁻ or Cr₂O₇²⁻) and the reductant.
- Balancing the atoms and charges correctly in the specified acidic or basic medium.
- Combining the half-reactions to obtain the final balanced equation.
8. What explanation is provided in the NCERT solutions for why most transition metal compounds are coloured?
The solutions explain that the colour in transition metal compounds arises from d-d transitions. When visible light falls on a compound, the d-electrons absorb energy of a specific wavelength to get excited from a lower energy d-orbital to a higher energy d-orbital. The colour we perceive is the complementary colour of the light that was absorbed. The solutions clarify that ions with fully-filled (d¹⁰) or empty (d⁰) d-orbitals, like Zn²⁺ or Sc³⁺, are colourless because no d-d transition is possible.
























